
【题目】希溪同学在实验室里测定溶液中溶质的质量分数进行了如下实验,他取了锌和硫酸锌的混合物 22.6g,加入了 100g9.8%的稀硫酸,恰好完全反应,然后加入77.6g 水,得到不饱和溶液,流程图如下:
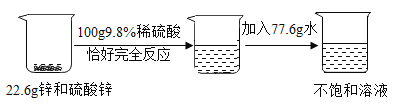
请根据上述内容回答下列问题:
(1)写出反应的化学方程式______________ ;
(2)根据已知条件列出参加反应锌的质量(X)的比例式_____________ ;
(3)反应后所得的不饱和溶液中溶质的质量分数是_______________ ;
(4)上述所用的 100 克 9.8%的稀硫酸是由 98%浓硫酸配制,需加入水的质量是_________;
(5)浓硫酸配成稀硫酸所用的仪器除了烧杯、玻璃棒外,还需的仪器是_____________ 。
【答案】Zn + H2SO4=ZnSO4+H2↑ ![]() 或
或![]() 16.1% 90g 量筒和胶头滴管
16.1% 90g 量筒和胶头滴管
【解析】
(1)锌和稀硫酸反应生成硫酸锌和氢气;
(2)100 克 9.8%的稀硫酸中的溶质质量为100g× 9.8%=9.8g;
(3)根据硫酸质量计算锌的质量、生成硫酸锌的质量、同时得到氢气质量,最后计算
反应后所得的不饱和溶液中溶质的质量分数;
(4)溶液加水稀释过程中,溶质质量不变;
(5)量取液体的仪器是量筒和胶头滴管。
(1)锌和稀硫酸反应生成硫酸锌和氢气,化学方程式为Zn + H2SO4=ZnSO4+H2↑;
(2)100 克 9.8%的稀硫酸中的溶质质量为100g× 9.8%=9.8g,根据已知条件列出参加反应的锌质量(X)的比例式![]() 或
或![]() ;
;
(3)设锌的质量为x,生成硫酸锌的质量为y,同时得到氢气质量为z。
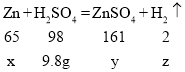
![]() ,x=6.5g,y=16.1g,z=0.2g。
,x=6.5g,y=16.1g,z=0.2g。
反应后所得的不饱和溶液中溶质的质量分数是![]() ;
;
(4)上述所用的 100 克 9.8%的稀硫酸是由 98%浓硫酸配制,需加入水的质量是100g-9.8g÷98%=90g;
(5)浓硫酸配成稀硫酸所用的仪器除了烧杯、玻璃棒外,还需的仪器是量筒和胶头滴管。


科目:初中化学 来源: 题型:
【题目】下列化学方程式符合题意且书写和所属基本反应类型均正确的是( )
A. 不能用铁器盛放硫酸铜溶液的原因:Fe+CuSO4=FeSO4+Cu 置换反应
B. 铝耐腐蚀的原因:4Al+3O2=Al2O3 氧化反应
C. 工业上以赤铁矿为原料冶炼生铁:2Fe2O3+3C![]() 4Fe+ 3CO2↑ 还原反应
4Fe+ 3CO2↑ 还原反应
D. 电解水产生氢气和氧气:2H2O![]() 2H2↑+ O2 ↑ 分解反应
2H2↑+ O2 ↑ 分解反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是初中化学中验证物质性质的几个基本实验,回答下列问题。
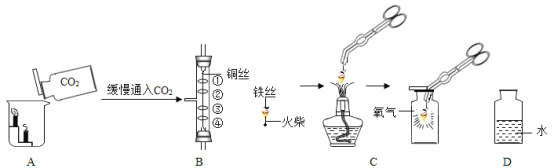
(1)将一瓶二氧化碳倒入盛有阶梯形蜡烛的烧杯中(如图A),观察到的现象是_____,此实验说明二氧化碳气体的性质有:________。
(2)如图B所示,其中①、④为用紫色石蕊溶液润湿的棉球,②、③为用石蕊溶液染成紫色的干燥棉球,实验过程中观察到的现象是:②、③不变红,①和④都变红且④比①先变红。据此现象推知二氧化碳的性质有____,反应的文字或化学符号表达式为______________。
(3)按C图实验时,集气瓶底部炸裂,其原因是_____________。
(4)某化学兴趣小组的同学探究带火星的木条在不同体积分数氧气中的复燃情况,部分实验数据记录如下:
氧气体积分数(%) | 30 | 40 | 60 | 70 |
带火星的木条 | 不变 | 稍亮 | 复燃 | 复燃 |
在集气瓶中注入占其容器50%的水(如图D所示,空气中氧气的体积分数为21%),用排水法收集氧气,将瓶内的水排尽,用带火星的木条在该集气瓶中进行实验,通过计算,该集气瓶收集的气体中氧气体积分数为_______,推测带火星的木条能否复燃______(填“能”或“否”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学按照教材的实验装置做“测定空气中氧气的体积分数”实验(如图甲所示),但测出的氧气体积分数明显小于理论值,请你参与探究。实验中所用的白磷在40℃即可燃烧,燃烧现象和产物与红磷相同。
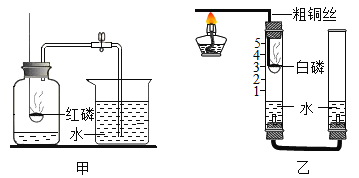
(提出问题)造成误差的原因是什么?如何改进课本实验装置?
(假设与猜想)
甲同学:可能是导管内原存有空气,后来留有吸入的水,影响实验的准确性;
乙同学:可能是瓶内残留气体中还有氧气的缘故;
你还能做的猜想是_____。
(交流与讨论)
(1)丙同学认为用木炭代替红磷就可以消除误差,大家认为他的猜想不合理,理由是_____;
(2)他们对课本实验装置进行了如图乙的改进(其他仪器省略)。
①在装药品之前应该先_____;
②利用铜的导热性,通过粗铜丝点燃玻璃管内的白磷:白磷燃烧的现象是_____;写出该反应的文字表达式_____;
③与课本实验装置相比,该装置的一个优点是_____;
④待玻璃管冷却至室温后左玻璃管内的液面最终停留在_____刻度处。
(探究与反思)
已知铜粉加热时可以和氧气反应生成黑色固体氧化铜。为验证乙同学的猜想,将铜粉放在残余气体中加热观察到铜粉变黑色证明乙同学的猜想_____(填“合理”或“不合理”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是氢气在氯气中燃烧生成氯化氢的微观模拟图,请回答下列问题:
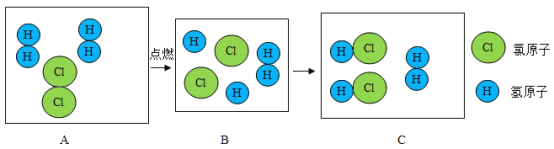
(1)此变化的微观实质是:______________________;
(2)此变化中不变的粒子是__________(填符号);
(3)画出比氯元素少一个周期,少一个族的离子结构示意图____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属在生活生产中有着非常广泛的应用,请回答下列问题。
(1)我国生产和使用铁器历史悠久,请写出工业用赤铁矿石炼铁的化学方程式:_____。生铁和钢的性能不同,原因是_____。
(2)铁在潮湿的空气中很容易生锈,请写出一种防止钢铁制品锈蚀的方法:_____。
(3)向硝酸银和硝酸铜的混合溶液中加入一定量的锌粉,操作流程如图所示。
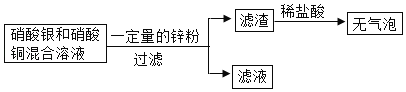
请回答:
①滤渣中一定含有的物质是_____(填化学式,下同)。
②若滤液呈蓝色,滤液中一定含有的溶质是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钠(Na2O2)是一种淡黄色固体,常温下与二氧化碳发生反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2。现将沾有过氧化钠固体的棉花放入烧杯中,再缓慢向烧杯中倒入适量稀硫酸,使之与杯底的Na2CO3反应产生CO2气体,发现蜡烛火焰熄灭,沾有过氧化钠固体的棉花燃烧起来。从实验获得信息中,你认为不正确的是
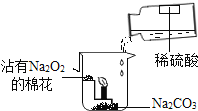
A. 棉花具有可燃性
B. CO2不支持蜡烛燃烧,但能支持棉花燃烧
C. Na2O2与CO2反应放热,使温度达到棉花的着火点
D. 棉花燃烧证明“可燃物、氧气、温度达到着火点”是燃烧必须同时具备的条件
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】探究氯酸钾和二氧化锰制氧气实验中反应物与催化剂的最佳质量比.
实验中采用图1实验装置,取20g氯酸钾,分成10等份,每份2g,分别装入10支试管中.在10支试管中分别加入不同质量的二氧化锰,分别测量二氧化锰与氯酸钾在不同质量比时,生成200ml氧气所消耗的时间.实验记录的数据如下:
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰的质量(g) | 0.1 | 0.2 | 0.33 | 0.4 | 0.5 | 0.66 | 1 | 1.3 | 2 | 3 |
二氧化锰与氯酸钾的质量比 | 1:20 | 1:10 | 1:6 | 1:5 | 1:4 | 1:3 | 1:2 | 2:3 | 1:1 | 3:2 |
生成200ml氧气时间(秒) | 235 | 186 | 162 | 147 | 133 | 117 | 143 | 160 | 211 | 244 |
请回答下列问题:
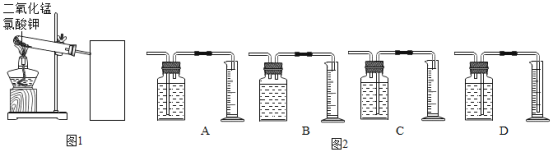
(1)为完成本实验,方框内应选择图2气体收集装置中的是_____(选填序号)该收集利用了氧气的_____性质.收集气体前集气瓶内未装满水,对实验结果_____(填“有”或“没有”)影响.
(2)分析上述数据,你认为利用此法制氧气,二氧化锰与氯酸钾的最佳质量比为_____.
(3)利用双氧水和二氧化锰的混合物制氧气比加热氯酸钾和二氧化锰混合物制氧气更好,请写出前者的两个优点①_____②
(4)催化剂能影响化学反应速度,温度、反应物的浓度、接触面积等也会对化学反应速度带来影响.分析上表数据,结合影响化学反应速度的
①当二氧化锰与氯酸钾的质量比高于最佳质量比时,反应速度变低的原因是_____.
②当二氧化锰与氯酸钾的质量比低于最佳质量比时,反应速度变低的原因是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是化学学习的重要工具,依据下表回答问题:

(1)表中14号元素属于______(填“金属”或“非金属”)元素,该元素的化学性质与_______元素相似,即在常温下具有__________性。
(2)通过上表的分析可知:元素所在的周期数=该元素原子核外的___________________。
(3)在化学反应中,铝原子失电子形成铝离子,写出铝离子符号__________。
(4)钠元素与氧元素形成的化合物化学式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com