
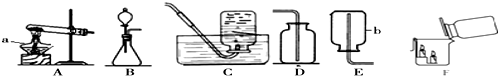
分析 制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳.如图F所示,将二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上 依次熄灭,说明二氧化碳具有的性质是把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;虽然常温常压下乙烯(C2H4)不与空气反应,但因密度很接近空气而不用排空气法收集.若用排空气法收集乙烯,将得到气体的质量不纯;排水法收集乙烯时,待导气管口连续稳定地冒出气泡才开始收集,原因是:排出装置内的空气,避免收集的乙炔不纯.实验室收集某气体只能用装置E,由此说明该气体具有的物理性质是:易溶于水,密度比空气小.
解答 解:(1)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;如图F所示,将二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上 依次熄灭,说明二氧化碳具有的性质是把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;B;把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;
(2)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;故答案为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;CE;
(3)虽然常温常压下乙烯(C2H4)不与空气反应,但因密度很接近空气而不用排空气法收集.若用排空气法收集乙烯,将得到气体的质量不纯;排水法收集乙烯时,待导气管口连续稳定地冒出气泡才开始收集,原因是:排出装置内的空气,避免收集的乙炔不纯;故答案为:得到气体的质量不纯;排出装置内的空气,避免收集的乙炔不纯;
(4)实验室收集某气体只能用装置E,由此说明该气体具有的物理性质是:易溶于水,密度比空气小;故答案为:易溶于水,密度比空气小;
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、气体的检验和性质等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


科目:初中化学 来源: 题型:选择题
| A. | H2O$\frac{\underline{\;点燃\;}}{\;}$O2+2H2 | B. | 4Fe+3O2=2Fe2O3 | ||
| C. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2 | D. | 2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 实验方案 | 使用的试剂 | 判断的方法 |
| A | 铁粉 | 如果有气泡产生,表明盐酸已经过量 |
| B | pH试纸 | 如果pH<7,表明盐酸已经过量 |
| C | 硝酸银溶液 | 如果有白色沉淀产生,表明盐酸已经过量 |
| D | 紫色石蕊试剂 | 如果溶液变成红色,表明盐酸已经过量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 浓硫酸(H2SO4)500毫升 | |
| 溶质的质量分数 | 98% |
| 密度 | 1.84克/厘米3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封储藏 | |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
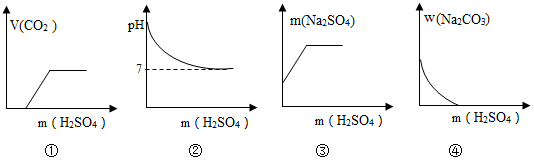
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com