
【题目】实验室欲配制1 000g溶质质量分数为4%的氢氧化钠溶液![]() 请回答下列问题;
请回答下列问题;
(1)配制步骤
①计算:需氢氧化钠固体 ______ g,______mL水,
②称量:用质量为23.1g的烧杯作称量容器,托盘天平上称取氢氧化钠固体时,盛有氢氧化钠固体的烧杯应放在 ______ 盘![]()
③溶解:将氢氧化钠固体溶于水,用玻璃棒搅拌,使氢氧化钠全部溶解,冷却至室温.
④装瓶:把配好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中![]() 在装有所配制溶液的试剂瓶(见图)
在装有所配制溶液的试剂瓶(见图)![]() 标签上标明相应的两个信息为: ______
标签上标明相应的两个信息为: ______
(2)在配制过程中,导致溶液中氢氧化钠质量分数小于4%的可能原因是 ______
①用量筒量取水时俯视读数;
②配制溶液的烧杯用少量蒸馏水润洗;
③在托盘天平的左盘称取氢氧化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数;
④盛装溶液的试剂瓶用蒸馏水润洗;
⑤氢氧化钠固体不纯。
A ①②③④⑤ B 只有①②④⑤ C 只有①②⑤ D 只有②③④⑤
(3)若老师提供的药品有500g8%的氢氧化钠溶液,500g1%的氢氧化钠溶液,足量的氢氧化钠固体和水,除了上述配制方案外,还可以用500g1%的氢氧化钠溶液,再加 _____________ 来进行配制。
【答案】40 960 左 氢氧化钠溶液4% D 35g氢氧化钠和465g水
【解析】
溶质质量等于溶液质量乘以溶质质量分数,托盘天平称量物体是左边放物体,右边放砝码,溶液质量等于溶质质量加溶剂质量。
(1)配制步骤
①计算:需氢氧化钠固体为![]() ,水的质量为
,水的质量为![]() 。
。
②称量:用质量为23.1g的烧杯作称量容器,托盘天平称量物体是左边放物体,托盘天平上称取氢氧化钠固体时,盛有氢氧化钠固体的烧杯应放在左盘。
④装瓶:把配好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中,在装有所配制溶液的试剂瓶,标签上标明相应的两个信息为:氢氧化钠溶液4% 。
(2) ①用量筒量取水时俯视读数,读数偏大,导致溶液中氢氧化钠质量分数大于4%;
②配制溶液的烧杯用少量蒸馏水润洗,相对于增加溶剂,导致溶液中氢氧化钠质量分数小于4%;
③在托盘天平的左盘称取氢氧化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数,溶质质量变小了,导致溶液中氢氧化钠质量分数小于4%;
④盛装溶液的试剂瓶用蒸馏水润洗,相对于增加溶剂,导致溶液中氢氧化钠质量分数小于4%;
⑤氢氧化钠固体不纯,氢氧化钠固体减小,导致溶液中氢氧化钠质量分数小于4%,故选D。
(3)若老师提供的药品有500g8%的氢氧化钠溶液,500g1%的氢氧化钠溶液,足量的氢氧化钠固体和水,除了上述配制方案外,还可以用500g1%的氢氧化钠溶液,500g1%的氢氧化钠溶液中含溶质的质量为![]() ,需要加氢氧化钠固体的质量为
,需要加氢氧化钠固体的质量为![]() ,水的质量为
,水的质量为![]() ,故再加35g氢氧化钠和465g水来进行配制。
,故再加35g氢氧化钠和465g水来进行配制。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊分别代表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,它们之间相互反应的关系如图所示。已知物质与戊的反应中:戊与甲或戊与乙的反应类型不同于其它几个反应;丙与戊反应能产生一种气体,且该气体还能与丁反应生成沉淀。下列对应关系正确的是( )
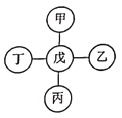
甲 | 乙 | 丙 | 丁 | 戊 | |
A | 硝酸银 | 铁 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
B | 硝酸银 | 碳酸钙 | 稀盐酸 | 氢氧化钡 | 铁 |
C | 铁 | 氢氧化钡 | 碳酸钙 | 硝酸银 | 稀盐酸 |
D | 铁 | 硝酸银 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一定温度下,向烧杯中加入一定质量的水,仅有部分晶体溶解.所得溶液与原溶液相比,说法正确的是( )
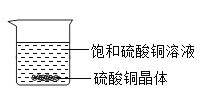
A.溶剂的质量增加,溶液颜色变浅 B.溶质溶解度不变,溶液颜色变深
C.溶质的质量增加,溶液颜色变深 D.溶质溶解度不变,溶液颜色不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定质量的AgNO3和Fe(NO3)2的混合溶液中加入a克Zn粉,充分反应后过滤,将洗涤、干燥后称量,得到的固体质量为a克。据此,下列说法正确的是( )
A. 滤液中的物质一定至少有两种
B. 取反应后的滤液滴加稀盐酸,可能有白色沉淀产生
C. 取滤渣滴加稀盐酸,一定有气泡产生
D. 取反应后的滤液观察,滤液一定呈无色
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题:

(1)P点含义__________________;
(2)t2℃时,将15g A物质放入50g水中,充分溶解后,形成溶液的质量为____g;
(3)若A物质中含有少量的B物质,提纯A物质的方法是_____;(填“降温结晶”或“蒸发结晶”)
(4)t3℃时,将A、B、C三种物质的饱和溶液降温到t1℃,三种溶液中溶质的质量分数由大到小的顺序为___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】了解物质的组成和结构,有助于认识物质的性质和变化。
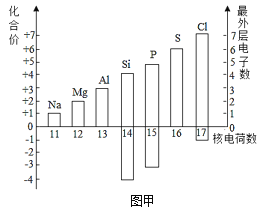
(1)图甲表示核电荷数为11~17的元素最高和最低化合价和原子的最外层电子数。
①若某元素既可显正价,又可显负价,则最高正价与最低负价绝对值的代数和为_____。硫元素既可显正价,又可显负价,硫元素与钠元素形成的化合物由_____(填“分子”、“原子”或“离子”)构成,其化学式为_____。
②铝原子失去最外层电子所形成的离子符号为_____。
③写出图中元素的化合价与最外层电子数有关的一条规律_____。
(2)将NaOH、KCl、MgCl2三种溶液按一定比例混合,微观变化情况如图乙。
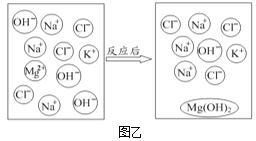
①图中OH-的名称是_____。
②该反应的本质是_____结合生成沉淀。
③写出与上述反应本质相同的另一反应的化学方程式:_____(反应物之一为MgCl2)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
Mg、Zn、Fe与稀盐酸反应 | 等质量等质量分数的盐酸与足量的镁粉、锌粉 | 将铜片加入一定量的硝酸银溶液中 | 向一定质量的氯化锌和盐酸溶液中加入锌粒 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组通过探究活动学习和理解化学知识.请你一起研究学习,并回答有关问题.
研究主题:水溶液中复分解反应的实质
相关信息:一定体积的溶液中,离子的数目越多,其离子的浓度越大.电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小.相同温度下同种溶液电导率越大,离子浓度越大.
(1)实验一:恒温条件下,向100mL一定浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示.
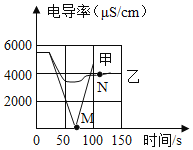
①甲曲线M点时混合液体呈_____色;
②通过对甲曲线的分析,下列说法错误的是_____(填序号).
a.M点前曲线下滑的过程中,H+和OH﹣结合成H2O,Ba2+和SO42﹣结合成BaSO4
b.M点时离子浓度几乎为零
c.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
③经测定,M点时消耗稀H2SO4溶液50mL,且过滤后滤液质量为147. 67g。请计算原Ba(OH)2溶液的溶质质量分数_____ (写出计算过程,各种稀溶液的密度都可看成1g·mL-1)。
(2)实验二:恒温条件下,向100mL同浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示.
①通过对乙曲线的分析,下列说法错误的是_____(填序号).
a.开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
b.电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
c.整个实验过程中,溶液中Na+数目一直增大
②N点时,溶液中含有的离子是______________(填离子符号).
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度_____(填“增大”或“减小”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组的利用提供的试剂:稀硫酸、澄清石灰水、氯化钠溶液、硫酸铜溶液和紫色石蕊溶液。探究酸碱盐的性质。小清同学将氯化钠溶液加入到稀硫酸中没有观察到明显现象,而将混合溶液加热一段时间后,意外地闻到刺激性气味。
[提出问题]刺激性气味的气体是什么?
[猜想与假设]猜想1.可能是二氧化硫 猜想2.可能是氯化氢
猜想3.可能是氨气
大家讨论后认为猜想3不合理,依据是_____________________。
[查阅资料] SO2和CO2的化学性质相似,都能使澄清灰水变浑浊。写出二氧化硫和氢氧化钙的反应的化学方程式:____________________________。
[实验探究]如图所示,小诚将产生的气体通入紫色石蕊溶液中,观察到_________,于是他认为猜想2正确。
[评价与改进]小煜认为小诚的结论不科学,于是他利用提供的试剂通过实验确认了猜想2正确。
实验操作 | 实验现象 |
如图所示,将产生的气体________________ | _____________________ |
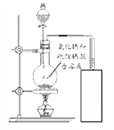
[结论]加热氯化钠与硫酸的混合溶液得到的气体是氯化氢
[拓展应用]实验室可用氯化钠和硫酸反应制取氯化氢气体,已知氯化氢气体极易溶于水。请推测实验室制取氯化氢气体最适宜的方法为________________(填序号)。
A.加热氯化钠溶液和稀硫酸的混合物 B.加热氯化钠固体和稀硫酸的混合物
C.加热氯化钠固体和浓硫酸的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com