
����Ŀ���ڢ֣��û�ѧ��������ȡ���������ʣ���ѧ��ȤС��Ӧ���кͷ�Ӧԭ����ȡ�Ȼ��ƹ��塣
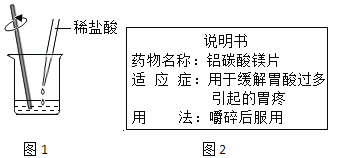
��1����װ������������Һ���ձ��е�����ɫʯ����Һ����Һ��_____ɫ��
��2����ͼ1�������ձ��м�����εμ�ϡ��������Һǡ�ñ�Ϊ��ɫ��������Ӧ�����Һ�м������̿����ֻ�ϣ����˺�õ���ɫ��Һ��
�ټ������̿��Ŀ����_____��
���ڹ��˲����У���������������_____��
��3����pH��ֽ�⣨2������Һ�����ȣ������������ȡpH��ֽ�ڲ���Ƭ�ϣ�_____������ֽ��ʾ����ɫ�����ɫ���Ƚϣ�������Һ��pH��
��4���������ҺpHΪ8����������Һ�μ��Թ��������ᣬĿ����_____����������Һ�Գ�ȥ���������ᣬ�ò������õ������������_____������������Һ�õ�����Ĺ����У��ò��������Ͻ����Ŀ����_____��
�ڢ֣�θ���������ÿ���ҩ��������ᷴӦ������ͼ2Ϊ��̼��þ˵����IJ������ݡ���ȤС��Ը�ҩ�↑չ����̽����
��1����ҩ������õ�̽��
���ϱ�������̼��þ[����Ҫ�ɷֵĻ�ѧʽΪAlMg(OH)3CO3]�����ᷴӦ�Ļ�ѧ����ʽΪ��AlMg(OH)3CO3+5HCl=MgCl2+AlCl3+4H2O+CO2��
�ٽ���Ӧ����������ͨ�����ʯ��ˮ�����۲쵽��������_____���÷�Ӧ�Ļ�ѧ����ʽΪ_____��
�ڸ������к���Al3+��Mg2+��OH����![]() ����ϸ����������ᷴӦ�Ļ�ѧ����ʽ��������ҩ���������ã�����θҺ���ԣ�������_____��_____���������ţ���
����ϸ����������ᷴӦ�Ļ�ѧ����ʽ��������ҩ���������ã�����θҺ���ԣ�������_____��_____���������ţ���
��2�����÷�����̽��
�ÿ���ҩΪʲôҪ����������������С������������������ͬ������ҩƬ���������ã������ĸ����θ������С������Ϊ�������ҩ�ォ��θҺ�е����ᷴӦ������
����Ȼ��С������Ǵ���ġ�ԭ����_____��
��С�����������ʵ����֤���Լ��IJ��룺
��ʵ��1����һƬ������ҩƬ�����Թ��У������м���5mL5%��ϡ���
��ʵ��2����һƬ������ҩƬ���������Թ��У������м���5mL5%��ϡ���ᡣ
�Ա�ʵ��1��ʵ��2��С���۲쵽������Ϊ_____��֤�������IJ�����ȷ��
��3����Ҫ�ɷֺ�����̽������ȤС��ȡ6ƬҩƬ���������Թ��У��������������ϡ���ᣬ��ַ�Ӧ��ų�����0.88g����ͨ�����㣬ÿƬҩ���к���AlMg(OH)3CO3�������Ƕ��٣�____�����������0.1������֪��ҩ�����������ɷֲ���ϡ���ᷴӦ��AlMg(OH)3CO3����Է�������Ϊ162��
���𰸡��� ������ɫ���� ���� ���ò�����պȡ��Һ��ճ��pH��ֽ�� ��ȥ�������������� �ӷ� ��ֹҺ�����Ȳ�������Һ�ηɽ� ����ʯ��ˮ����� Ca(OH)2+CO2=CaCO3��+H2O OH�� ![]() ��ͬ������ҩƬ���ĵ�θ��������� ʵ��2�в������ݵ����ʱ�ʵ��1�еĿ� 0.5g
��ͬ������ҩƬ���ĵ�θ��������� ʵ��2�в������ݵ����ʱ�ʵ��1�еĿ� 0.5g
��������
�ڢ֣�
��1������������Һ�ʼ��ԣ���ɫʯ����Һ���������
��2���ٻ���̿�����������ã���������ɫ���ʣ����ڹ��˲����У���������������������
��3����pH��ֽ�⣨2������Һ�����ȣ������������ȡpH��ֽ�ڲ���Ƭ�ϣ����ò�����պȡ��Һ��ճ��pH��ֽ�ϣ�����ֽ��ʾ����ɫ�����ɫ���Ƚϣ�������Һ��pH��
��4���������ҺpHΪ8��˵����Һ�ʼ��ԣ���������Һ�μ��Թ��������ᣬĿ���dz�ȥ�������������ƣ���������Һ���Գ�ȥ���������ᣬ����Ϊ��������ӷ������ʣ�����������Һ�õ�����Ĺ����У�Ӧ�ò��������Ͻ��裬��ֹҺ�����Ȳ�������Һ�ηɽ���
�ڢ֣���1���ٸ÷�Ӧ����������Ϊ������̼����ʹ����ʯ��ˮ����ǣ�������Ϊ�������ƺͶ�����̼��Ӧ������̼��Ƴ�����ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ��Ca(OH)2+CO2=CaCO3��+H2O��
�ڸ������к���Al3+��Mg2+��OH����![]() ������OH����
������OH����![]() ����H+��Ӧ�������������ܺ�ϡ�����е������ӽ�ϳ�ˮ��̼��������ܺ�ϡ�����е������ӽ������ˮ�Ͷ�����̼��
����H+��Ӧ�������������ܺ�ϡ�����е������ӽ�ϳ�ˮ��̼��������ܺ�ϡ�����е������ӽ������ˮ�Ͷ�����̼��
��2��ҩ�����ǰ����������ı䣬��ͬ������ҩƬ���ĵ�θ��������ȡ�
����ʵ��2�в������ݵ����ʱ�ʵ��1�еĿ죬��֤���������ҩ�ォ��θҺ�е����ᷴӦ������
��3����ÿƬҩ���к���AlMg(OH)3CO3������Ϊx��
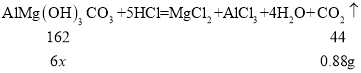
![]()
x=0.54g![]() 0.5g��
0.5g��
��ÿƬҩ���к���AlMg(OH)3CO3��������0.5g��


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ������ɻ�ȱ��һ�����ʡ� ������ʶ��,�����ں����ؽ���ʹ�á�
(1)���ݺܶ�ط�������Ȫ��ȡij����Ȫˮ��,��ȴ�����º����̽���������Ȫˮ����pH=7.4.��֪����Ȫˮ����_______________�ԡ�
(2)��ͼ���ܷ�ӳˮ�ڿ����з���ʱ�����仯����ʾ��ͼ��_______________��(����ĸ���)(ͼ�С�![]() ����ʾ��ԭ��,��
����ʾ��ԭ��,��![]() ����ʾ��ԭ��)
����ʾ��ԭ��)
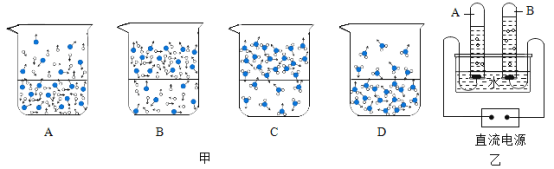
(3)��ͼ�ǵ��ˮ��װ�á�
���뻭ͼ��ʾ�ñ仯���۹���:_______________��
��ͨ����ʵ�飬�ɵó�����ˮ����ɵĽ���:_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ����ʵ���г��õ�װ�ã������Ҫ��ش����⣺
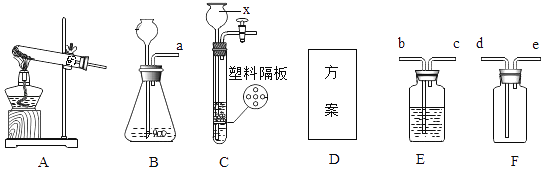
��1����������غͶ���������ȡ��������ѧ����ʽ��_____�����巢��װ��Ӧѡ��_____������ţ������Թ��м���ҩƷǰӦ�ȼ���_____��
��2������x��������_____����Ҫ�Ƶø���Ķ�����̼����ѡ����װ�ú��ռ�װ���⣬��Ҫѡ��װ��_____�����ڸ�װ����ʢ��_____����ҩƷ���ƣ����ռ�����ʱ����Ӧ��_____�˽��뼯��ƿ��
��3��ij�о���ѧϰС�齫���ǣ���Ҫ�ɷ�����ʯ��ʯ������B����ƿ�У�ע��ϡ���ᣬ�����D�������������������ʲô����D�����е�������ҩƷ�ֱ���_____��_____��D�������������ԭ���ǣ��û�ѧ����ʽ��ʾ��_____��
��4��ͼ��C��һ�ָĽ�װ�ã����ϸ����������ÿ�״���壩����ע��ϡ��������ûп���رջ������ɹ۲������������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��a��b��c�������ʵ��ܽ�����ߣ�a��c���ܽ�������ཻ��P�㡣��ͼ�ش�
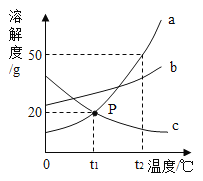
��1��P������___________________________��
��2��t2 ��ʱ30g a���ʼ��뵽50gˮ�в��Ͻ��裬�γ�___________g��Һ��
��3��t2 ��ʱa��b��c�������ʵ��ܽ�Ȱ���С�����˳��������________________����д������ţ���
��4����t2 �棬��������ͬ�� a��b��c�������ʷֱ����Ʊ�����Һ�����ñ�����Һ����������_________��Ȼ��ֱ�ȡ�������ĵ� a��b��c�������ʱ�����Һ���µ�t1 ��ʱ���������������� ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѣ�C2H6O����������Ⱦ��������������������ܳ�Ϊһ��ȫ�µ������Դ���ռ��� �йض����ѵ�������ȷ����
A.�������� 9 ��ԭ�ӹ���
B.2.3 g �������к�̼Ԫ�ص�����Ϊ 1.2 g
C.��������̼���⡢������Ԫ�ص�������Ϊ 2�U6�U1
D.�����Ѻͼ�������������ȫȼ�յIJ��ﲻ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ͼʾ��ʵ�飬�ش��й����⣺
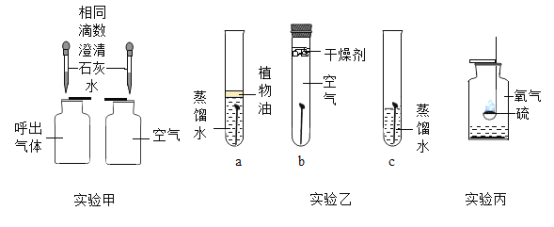
��1��ʵ���Ŀ����_________��
��2��ʵ������̽�������������ĶԱ�ʵ�飬����_________�Ա�˵����������Ҫˮ��
��3��ʵ���������������ȼ�գ�����_________ɫ���棬�ų����������ɴ̼�����ζ�����塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��װ������������ȡ������ʵ�顣
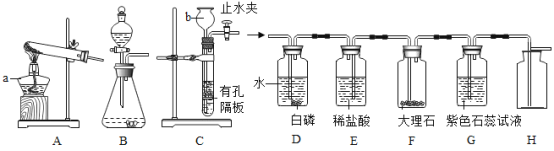
��1������b������_____��
��2����˫��ˮ�Ͷ������̻����������Ϊ�˵õ�ƽ�ȵ���������Ӧ��ѡ��ķ���װ���ǣ�����ţ�_____����Ӧ�Ļ�ѧ����ʽΪ_____����������������D����ߵ���ͨ��ʱ���ܿ쿴��G�е��ܿ�������ð����D�а���ʼ��û��ȼ�յ�ԭ����_____��E�й۲쵽��������_____��
��3��ʵ������У�F�з�Ӧ�Ļ�ѧ����ʽΪ_____��G����Һ����ɫ���ɫ��G����ɫ�仯��ԭ����_____���û�ѧ����ʽ��ʾ����
��4����Hװ�ÿ����ռ�ʣ�����壬Hװ���ռ������������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������θ��η�Ӧ�ķ���ʵ��ʱ����һ��ѧ������BaCl2��Na2CO3��Һ�ķ�Ӧ���ڶ���ѧ������BaCl2��Na2SO4��Һ�ķ�Ӧ��ʵ�����������ͬѧ��ȫ������Һ���е���һ����Һ���У���Һ�а�ɫ����������__��__��
��ѧ��ȤС�����Һ���й��ˣ�̽����Һ�ijɷ֣�
��������⣩��Һ�����NaCl�⣬����ʲô���ʣ�
��������룩����٣�__��
����ڣ�Na2SO4��
����ۣ�Na2CO3��
����ܣ�Na2CO3��Na2SO4
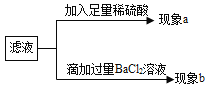
��ʵ��̽����
������aֻ�а�ɫ�����������__�����������ɳ����ķ�Ӧ����ʽΪ__��������aֻ�����ݲ����������__���ܳ���������������ķ�Ӧ����ʽΪ__��������b������ɫ������Ȼ���ϡ������������ܽ⣬���������ݣ������__������������ȫ�����ܽ⣬�����__������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ž��õķ�չ����Դ�뻷�����������ܵ����ǵĹ�ע�����ӡ�
��1��Ŀǰ�������Ի�ʯȼ��Ϊ��Ҫ��Դ����ʯȼ����ú��_____����Ȼ�������Ƕ�����_____�������������������������Դ��������ȫȼ�յĻ�ѧ����ʽΪ_____��
��2������ʯȼ�ϵĴ���ʹ�ã������_____�Ͷ���������������Ⱦ���Щ����������ڿ����з�����Ӧ���������������ˮ�����γ����ꡣ������������Ĵ�ʩ��_____����д��һ�㣩
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com