
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品放入试管中,滴加一定量的稀盐酸.用带异營的单孔橡皮塞塞紧试管口,导管另 一端伸入澄清石灰水中. | 试管中固体逐漸减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊. | 样品中一定含有Fe和CaCO3, 不含Fe2O3. |
| (2)取少量样品放入试管中,加水 溶解,静置后取上层清液滴加无 色酚酞试液. | 试管底部有不溶物,上层清液由无色变为红色. | 样品中含有氧化钙或氢氧化钙. |
分析 【实验探究1】从实验现象产生的原因去分析解答;
【实验质疑】从实验结论中的物质加水后发生的反应去分析解答;
【实验探究2】(1)过滤可以将固体与液体分开;
(2)根据方程式的质量比分析;
(3)氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠.
解答 解:【实验探究1】由题目中可知固体成分可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3,由表中实验现象:“试管中固体逐渐减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊.”说明固体和一种物质反应生成了二氧化碳气体(澄清石灰水变浊的气体),和一种含有Fe2+的物质(得到浅绿色溶液),实验室里制取二氧化碳气体的方法为用石灰石和稀盐酸反应,其化学方程式式为:CaCO3+2HCl═CaCl2+H2O+CO2↑,而铁也可以和稀盐酸反应生成氯化亚铁和氢气,其化学方程式为:Fe+2HCl═FeCl2+H2↑,可以推出加入的这种物质为稀盐酸,固体物质中一定有的物质是Fe和CaCO3;其他的固体物质中可以和稀盐酸反应的有:①氧化钙和盐酸反应生成氯化钙(溶液为无色)和水,其反应化学方程式为:CaO+2HCl═CaCl2+H2O;②氢氧化钙和盐酸反应生成氯化钙(溶液为无色)和水,其反应的化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;③氧化铁和盐酸反应生成氯化铁(溶液为黄色)和水,其反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O.由于最后所得溶液没有显黄色,也就是溶液中没有,所以固体物质中一定没有Fe2O3.
故答案为:稀盐酸;Fe和CaCO3;
加水溶解后,氧化钙可和和水反应生成氢氧化钙,同时反应放出大量的热,生成的氢氧化钙的溶液呈碱性,能使无色的酚酞试液变成红色;
故答案为:氧化钙或氢氧化钙;
【实验质疑】由于氧化铁和盐酸反应生成的氯化铁,可能会继续与铁反应生成氯化亚铁;
故答案为:Fe2O3+6HCl═2FeCl3+3H2O;Fe+2FeCl3=3FeCl2;
【实验探究2】(1)过滤可以将固体与液体分开,故答案为:过滤;
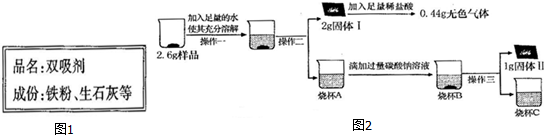
(2)取3g样品研碎,并用磁铁充分吸引后,得到剩余固体2.6g,所以已经出去了铁粉,溶解过滤的固体Ⅰ的质量为2g,其中含有碳酸钙还可能有氧化铁,由碳酸钙与盐酸反应方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑;
100 44
由于生成气体0.44g所以固体Ⅰ中含有1g碳酸钙,所以固体Ⅰ中含有碳酸钙和氧化铁,
故答案为:CaCO3和Fe2O3
(3)氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
故答案为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
答案:
【实验探究1】
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品放入试管中,滴加一定量的 稀盐酸.用带异營的单孔橡皮塞塞紧试管口,导管另 一端伸入澄清石灰水中. | 试管中固体逐漸减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊. | 样品中一定含有 Fe和CaCO3, 不含Fe2O3. |
| (2)取少量样品放入试管中,加水 溶解,静置后取上层清液滴加无 色酚酞试液. | 试管底部有不溶物,上层清液由无色变为红色. | 样品中含有 氧化钙或氢氧化钙. |
点评 本考点既考查了实验步骤的设计,又考查了化学方程式的书写,还对实验进行了评价,综合性比较强.实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究.同学们要具体分析,综合掌握.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 解释与结论 |
| 分别取三支试管,向其中加入等质量、等浓度的稀硫酸,然后将铝、铬、铜三种金属片分别插入三支试管中 | 铝片表面产生气泡较快;铬片表面产生气泡较缓慢,溶液变蓝色;铜片无明显现象 | 猜想二成立. 铬与稀硫酸反应生成蓝色的硫酸亚铬(CrSO4),反应的化学方程式为Cr+H2SO4=CrSO4+H2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:
如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
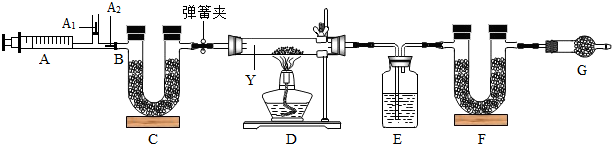
| 反应前 | 反应后 | |
| 装置E的质量/g | 100.0 | 102.25 |
| 装置F的质量/g | 50.0 | 51.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 食用铁强化酱油有助于预防缺铁性贫血 | |
| B. | 为提高牛奶的含氮量,可向牛奶中加入适量三聚氰胺 | |
| C. | 饮用硬水对身体有害,可用肥皂水区分硬水和软水 | |
| D. | 回收处理废旧电池及金属既可节约金属资源又可减少环境污染 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
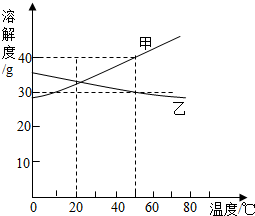
| A. | 50℃时,甲的饱和溶液溶质的质量分数为40% | |
| B. | 20℃时,甲乙两种物质的溶解度一定相等 | |
| C. | 降低温度,可使乙的不饱和溶液变为饱和溶液 | |
| D. | 升高温度,可使甲的不饱和溶液变为饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com