
【题目】用右图装置可以探究二氧化碳的制取和性质。下列关于该实验的叙述正确的是
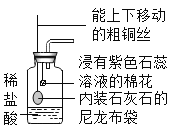
A.浸有紫色石蕊试液的棉花会变蓝
B.粗铜丝能控制反应的发生和停止
C.产生的二氧化碳可用生石灰干燥
D.能验证二氧化碳的密度比空气大
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:初中化学 来源: 题型:
【题目】现有X、Y、Z三种元素,其中X原子核内只有一个质子;Y原子L层电子数是K层电子数的2倍;X与Z形成的化合物的分子式为ZX3,每个分子内有10个电子。请回答下列问题:写出Z元素的原子结构示意图_____;X分别与Y、Z形成的化合物中,具有5个原子核的微粒的符号为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)下列有关说法不正确的是( )
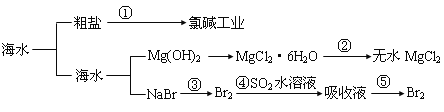
A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程
B.过程②中结晶出的 MgCl2·6H2O 要在 HCl 氛围中加热脱水制得无水 MgCl2
C.在过程③⑤中溴元素均被氧化
D.过程①中除去粗盐中的 SO42- 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH 溶液→BaCl2溶液→过滤后加盐酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列四个图像分别对应四种操作(或治疗)过程,其中正确的是( )
A. 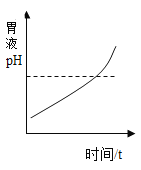 用胃舒平主要成分[主要成分Al(OH)3]治疗胃酸过多时pH变化情况
用胃舒平主要成分[主要成分Al(OH)3]治疗胃酸过多时pH变化情况
B. 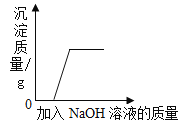 向氯化铁溶液中加入氢氧化钠溶液直至过量
向氯化铁溶液中加入氢氧化钠溶液直至过量
C. 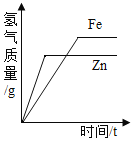 常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
D. 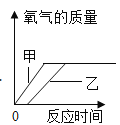 用过氧化氢分解制取氧气:加入二氧化锰(甲)与单独加热(乙)生成氧气的质量
用过氧化氢分解制取氧气:加入二氧化锰(甲)与单独加热(乙)生成氧气的质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知氨基丙酸的结构简式为
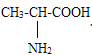
它可与NaOH反应生成氨基丙酸钠,其化学式为C3H6O2NNa又知味精的主要成分是谷氨酸一钠,它可由谷氨酸与NaOH反应生成,其结构简式为:![]()
已知它具有下列有关性质:①常态下为白色晶体,含有一分子结晶水,无气味,易溶于水,有肉类鲜味;②在碱性条件下会生成似成非成、似涩非涩的谷氨酸二钠,鲜味降低;③在150°C时失去结晶水,在210°C时生成对人体有害的焦谷氨酸盐,并在270°C左右进一步分解。根据以上信息填空:
(1)氨基丙酸与氢氧化钠反应的化学方程式为_____;
(2)写出谷氨酸二钠结构简式:_____;
(3)使用味精适宜的条件是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】关于如图所示的电解水实验,下列说法不正确的是
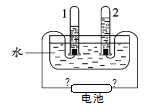
A.收集少量试管1气体移近酒精灯可发出尖锐爆鸣声
B.试管2连接的电池正极一端
C.试管1和试管2中气体的体积比为2:1
D.实验证明水是由氢分子和氧分子构成的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】 “天气瓶”是一个瓶内晶体可发生变化的装饰品。“天气瓶”内的液体主要成分是:

①硝酸钾、氯化铵和水的混合溶液
②溶质质量分数为24 %的樟脑的酒精溶液
下列说法中,不正确的是
A.溶液中的溶质可以为多种
B.樟脑的酒精溶液中酒精是溶剂
C.溶质质量分数为24 %的含义是指每100 g的溶剂中,溶质是24 g
D.“天气瓶”中晶体量变化的原因可能是物质的溶解度随温度改变而变化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国矿物种类齐全,储量丰富。工业上从从含有金属元素的矿石中提炼金属。其中赤铁矿是炼铁的主要原料。请回答下列问题:
I.铁制品广泛应用于生产、生活中。
(1)下列不属于铁合金的是_____________(选填字母)。
A.Fe(OH)3 B.生铁 C.不锈钢
(2)铁钉生锈,属于_____变化(选填“物理”“化学”):右图是探究铁钉在不同条件下发生生锈的实验,其中铁锈蚀最快的是______(选填字母)。
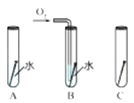
II.赤铁矿(主要成分为Fe2O3)可用于生产催化剂。
(3)在Fe2O3中,氧元素的质量分数为_____________。
(4)赤铁矿经提纯后得到的纯净Fe2O3可用于生产某种工业催化剂(主要成分为FeO和Fe2O3),其反应原理为:2 Fe2O3+C![]() 4FeO+CO2↑。现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,右图为固体混合物的质量随反应时间的变化曲线。
4FeO+CO2↑。现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,右图为固体混合物的质量随反应时间的变化曲线。
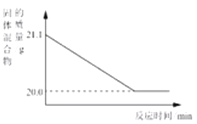
①由图可知:生成CO2气体的质量为_____g。
②计算反应后固体混合物中FeO的质量分数(请根据化学方程式写出完整的计算步骤)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com