
科目: 来源: 题型:
【题目】甲、乙两种物质的溶解度曲线如图1所示。下列说法中正确的是( )
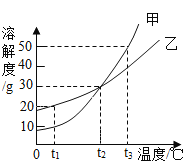
A.t1℃ 时,甲饱和溶液的溶质质量分数小于乙饱和溶液的溶质质量分数
B.t2℃ 时,甲、乙饱和溶液的溶质质量分数都为30%
C.t2℃ 时,等质量的甲、乙的饱和溶液分别降温至t1℃,所得溶液的质量甲大于乙
D.t2℃ 时,质量相同的甲、乙的饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于需加入乙的质量
查看答案和解析>>
科目: 来源: 题型:
【题目】为减少温室气体二氧化碳的排放,可以将二氧化碳进行转化。下图为该反应的微观示意图,以下说法成立的是 ( )
反应前 | 反应后 |
| ||
A | B | C | D | |
|
|
|
| |
A.物质C是由离子构成B.以上4种物质中属于氧化物的是A和C
C.反应中C,D两种物质的质量比是1︰2D.该反应属于置换反应
查看答案和解析>>
科目: 来源: 题型:
【题目】除了金、银等极少数金属外,绝大多数金属元素以化合物(即金属矿物)的形式存在于自然界。将金属矿物中的金属还原出来的过程在工业上称为金属的冶炼。利用金属活动性的不同,可以采用不同的冶炼方法。
一、热分解法:对一些非常不活泼金属,可以直接用加热分解的方法从其化合物中还原出来。例如:2HgO![]() 2Hg+O2↑;2Ag2O
2Hg+O2↑;2Ag2O![]() 4Ag+O2↑;
4Ag+O2↑;
二、电解法:对一些非常活泼的金属,采用一般的还原剂很难将它们还原出来,工业上常用电解法冶炼。例如:MgCl2(熔融)![]() Mg+Cl2↑; 2NaCl(熔融)
Mg+Cl2↑; 2NaCl(熔融)![]() 2Na+Cl2↑;
2Na+Cl2↑;
三、热还原法:大部分金属的冶炼都是通过在高温下发生的氧化还原反应来完成的,常用的还原剂有焦炭、一氧化碳、氢气等。一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。
根据上述信息回答下列问题:
(1)不能用热分解法制得的金属是______________;
A Cu B Fe C Ag D Hg
(2)下列反应不符合工业冶炼金属实际情况的是_____________;
A2MgO![]() 2Mg+O2↑ B 4CO+Fe3O4
2Mg+O2↑ B 4CO+Fe3O4![]() 3Fe+4CO2
3Fe+4CO2
C 2Al+Fe2O3![]() Al2O3+2Fe D 2KCl(熔融)
Al2O3+2Fe D 2KCl(熔融)![]() 2K+Cl2↑
2K+Cl2↑
(3)若从铅的矿物中冶炼铅,可使用上述方法中的__________,理由是__________________。
(4)电解熔融氯化钠可以得到金属钠,但是电解食盐水不能得到金属钠,测得电解饱和食盐水后所得溶液的pH大于7,则可知电解后一定有__________生成另外还有两种气体单质生成、写出电解饱和食盐水的化学方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一些金属易生锈,某小组同学设计如下实验,对金属锈蚀进行探究。
(实验一)取5枚去油去锈的洁净铁钉,分别装入下表的试管中,进行实验。
实验图示 |
|
|
|
|
|
生锈时间 | 8min | 较长时间不生锈 | 5min | 3min | 1min |
(1)通过上述实验可知,温度越高铁钉生锈速率越_____(填“慢”或“快”);在_____(填“酸性”、“碱性”或“中性”)环境中铁钉生锈速率较快。
(实验二)为探究铁锈的成分,用下图所示装置(夹持仪器已省略)进行实验(每步反应和吸收均完全).
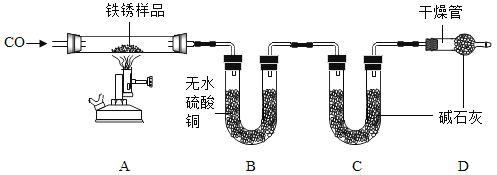
(查阅资料)①无水硫酸铜能吸收水而变蓝,
②碱石灰成分为氢氧化钠和氧化钙,既能吸收水也能吸收CO2。
(2)请指出该实验装置的一个缺陷:_____。
(3)A中加热前,先通入CO一段时间,目的是_____。
(4)将铁锈样品加热,样品逐渐变黑,无水硫酸铜逐渐变蓝,由此推知铁锈中一定含有_____元素,从而推断出空气中的_____参加了铁生锈反应。
(实验记录)
铁锈样品的质量/g | 装置B的质量/g | 装置C的质量/g | |
反应前 | 23.2 | 232.4 | 198.2 |
充分反应后 | 11.2 | 239.6 | 211.4 |
根据上表数据推算,可确定铁锈的成分,用FexOynH2O表示,则n=_____。
(5)若缺少D装置,x:y的值_____(填“偏大”、“偏小”或“无影响”)。
(实验三)小组同学将未经砂纸打磨的铝条放入盛有足量稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示。

(6)回答下列问题:
①ab段发生反应的化学方程式是_____。
②bc段发生反应的化学方程式是_____。
③cd段压强变化的主要原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中A—G为初中化学中常见物质,其中A、B、D是由两种元素组成的物质,且A、B所含元素种类相同;F可用于改良酸性土壤。它们之间的关系如下图所示(“—”表示相连两物质之间能发生反应,“→”表示由某一物质转化为另一物质,部分反应物生成物及反应条件己略去),每个虚线圈中各反应的基本反应类型相同。
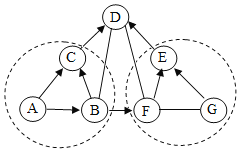
(1)写出物质的化学式:B_____;F_____。
(2)反应G→E的基本反应类型是_____。
(3)反应F—G的化学方程式是_____。
(4)实验室用A制取C的化学方程式是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】针对下列几个实验,回答相关问题
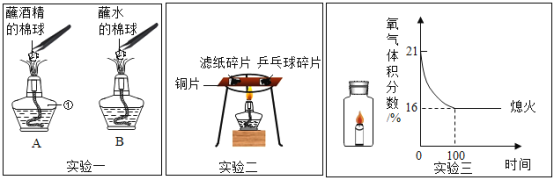
(l)仪器①的名称为_____;
(2)实验一:AB同时加热片刻后,A中棉球上的酒精燃烧产生蓝色火焰,B中棉球上的水不燃烧,由此得出燃烧的条件之一是_____;
(3)实验二:先燃烧的物质是_____;若将铜片上的物质换成等量的木屑和煤粉进行实验,观察到木屑先燃烧,说明木屑的着火点比煤粉_____;
(4)实验三:将燃着的蜡烛放在密闭集气瓶中,同时用氧气传感器测出其中氧气含量的变化如图所示,下列说法错误的是_____(填序号)。
A 蜡烛燃烧需要氧气
B 蜡烛燃烧前,密闭容器中氧气的体积分数为21%
C 蜡烛熄灭后,密闭容器中还有氧气
D 蜡烛熄灭后,密闭容器中的二氧化碳体积分数约为84%
(5)实验四:如图,打开止水夹,通过分液漏斗加入足量稀盐酸,看到乙试管溶液中有气泡冒出;一段时间后,再关闭止水夹,乙中溶液增多并变为浑浊。符合此实验现象的一组试剂是_____。
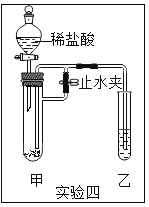
选项 | A | B | C | D |
甲中固体 | KOH | Na2CO3 | Zn | CaCO3 |
乙中溶液 | BaCl2 | NaOH | AgNO3 | Ca(OH)2 |
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下表为部分元素的原子结构示意图:
元素名称 | 氢 | 氦 | 碳 | 氧 | 钠 | 硫 |
元素符号 | H | He | C | O | Na | S |
原子结构 示意图 |
|
|
|
|
|
|
请回答下列问题:
①硫原子的结构示意图的最外层电子数x=_____。
②原子的核外电子排布,特别是最外层的电子数目,与元素的性质有密切的关系。表中具有相对稳定结构的原子是_____(填元素符号)。
③NaH是由离子构成化合物,其形成过程与氯化钠类似。简述NaH的形成过程_____。
④在化学反应中,如果有元素化合价升高,则必定有元素化合价降低。NaH能与水发生化学反应,生成碱和一种气体。甲同学认为生成的气体是O2,乙同学认为生成的气体是H2。从化合价角度分析,你认为哪位同学的说法正确?并说明理由。_____。
(2)汽车尾气催化转换器可将有害气体转化为无害气体排放,其反应过程的微观变化如下图:
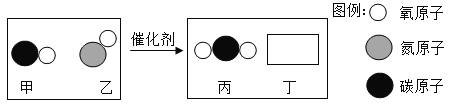
则丁是_____(写化学式),下列说法中正确的有_____。
A 该反应中含氧元素的物质有3种 B 该反应是置换反应
C 参加反应的甲和乙的质量比为14∶15 D 生成丙和丁的分子个数比为1∶1
(3)某无色气体X可能含有氢气、一氧化碳、二氧化碳和甲烷四种气体中的一种或两种。为确认其组成,取一定量该气体按图所示装置进行实验(假设每步都充分反应或吸收),结果装置①中无明显变化,装置③增重1.8g,装置④增重
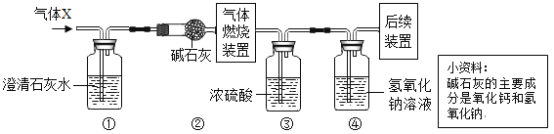
下列关于气体X成分的分析中,正确的有:_____。
A 一定没有二氧化碳 B 可能含有甲烷和氢气
C 可能只有甲烷 D 可能含有氢气和一氧化碳
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液与人们的生活息息相关。
(1)下列少量物质分别放入水中,充分搅拌,可以得到溶液的是_____(填字母)。
A 高锰酸钾 B 汽油 C 面粉 D 碘单质
(2)氢氧化钠、碳酸钠分别在水、酒精中的溶解度如表所示
氢氧化钠 | 碳酸钠 | ||||
20℃ | 40℃ | 20℃ | 40℃ | ||
水 | 109g | 129g | 21.8g | 49g | |
酒精 | 17.3g | 40g | 不溶 | 不溶 | |

①上述图象表示_____(填“氢氧化钠”或“碳酸钠”)的溶解度曲线。
②20℃时,氢氧化钠的溶解度_____(填“大于”或“小于”)碳酸钠的溶解度。
③40℃时,分别将50gNaOH分别投入到100g水和100g酒精中,能形成饱和溶液的是_____(选填“水”或“酒精”),再将适量CO2通入所得NaOH的酒精溶液中,观察到的现象为_____,反应的化学方程式为:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活息息相关。
(1)某食品的配料标签如图所示,

①该配料中富含蛋白质的物质是_____。
②从营养均衡角度看,该食品中除水外,还缺少的营养素是_____。
③这种食物对胃酸过多的病人有一定益处,原因是:_____。(用化学方程式表示)
(2)溧水地铁S7号线很快将正式开通。选择与此有关的以下三种材料填空(填字母):
①钢轨建设需要大量的钢铁,钢铁属于_____。
②座椅上常用到耐磨、耐腐蚀的涤纶等,涤纶属于_____。
A 金属材料 B 合成材料 C 复合材料
(3)某工厂每天产生含H2SO4的质量分数为1%废硫酸9.8t,如果用邻近工厂每天产生的废碱液(主要成分为NaOH)20t,恰好将其中和。求废碱液中NaOH的质量分数。_____(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示进行有关碳及其氧化物的性质实验,不正确的说法是
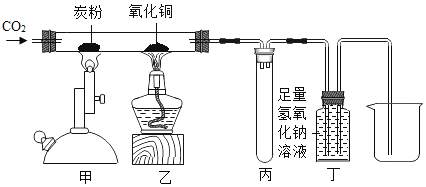
A.甲、乙两处的现象分别是:黑色粉末减少、黑色粉末逐渐变红
B.甲处发生的反应是的吸热反应
C.丙处可防止液体倒吸进硬质玻璃管中
D.该装置的不足之处是未进行尾气处理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com