
科目: 来源: 题型:
【题目】如图是甲、乙、丙三种物质的溶解度曲线,从图中获得的信息错误的是( )
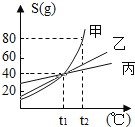
A.t1℃时甲、乙、丙三者的溶解度相等
B.甲的溶解度受温度的影响最大
C.要使t1℃时甲的饱和溶液变成不饱和溶液可以采取升高温度的方法
D.t2℃时,往100g水中加入90g甲,充分搅拌后得到190g甲的溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验室有带橡胶管的玻璃导管和下列仪器、装置可供选择,请填空:
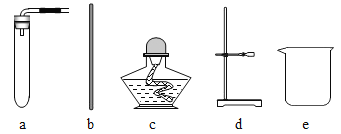
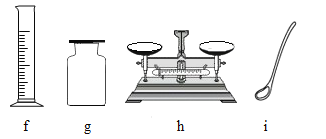
①用过氧化氢和二氧化锰制取并收集O2 ,所用仪器或装置有__________。(填序号)。
②用氯酸钾和二氧化锰制取O2,反应的化学方程式是_____________。
③要配制400g5%的NaOH溶液,所需NaOH固体的质量为______g,若称取NaOH固体所用小烧杯的质量为18.5 g,托盘天平的标尺最大刻度为5 g,砝码有5g、10g 、20 g、50 g几种规格,则称量时放在天平右盘的砝码质量为_________g;配制过程所需仪器除e、f、h和小烧杯、试剂瓶外,还需要_________(填仪器名称)。
(2)某兴趣小组同学将CO2分别通入澄清石灰水和氢氧化钠溶液中,观察到前者变浑浊,后者无明显现象。为探究CO2和NaOH是否发生了化学反应,王强设计了如图所示的A、B实验,验证CO2与NaOH溶液发生了化学反应。实验现象为;A中试管内液面上升;B中气球胀大。
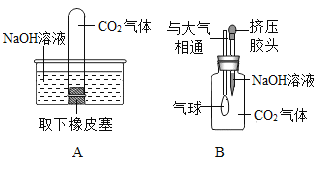
①王强认为上述实验是可行的,其共同原理是_________。
②李莉提出质疑,她认为上述实验不严谨,其理由是__________。要得到科学严谨的结论,仍利用该装置,补做的对比实验是____________
③杨红通过检验生成物:向B实验后的溶液中加入_____,观察到__________现象,从而也证明CO2与NaOH发生了反应。
④你认为两实验中存在安全隐患的是_________(填代号) ,理由是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某同学在学完“碳和碳的氧化物”单元后,对CO2的用途、制取等进行了简要总结,请你帮助他填写完成相关内容:
①二氧化碳在生产、生活中具有广泛用途,如可用作______、___、工业原料等。
②已知生成CO2的反应有多种,请用化学方程式表示出其中的4种,要求这4个反应分属不同的基本反应类型:
I____________,Ⅱ______________,
III_____________,IV______________。
(2)海水是一种重要的自然资源(海水中含NaCl 、MgCl2等物质) ,被誉为“国防金属”的镁主要是从海水中提取的,下面是从海水中提取金属镁的简单流程。
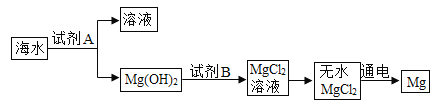
①从海水中获得淡水,常用的方法是____________。
②从海水中获得粗盐,可将海水进行__________________。
③试剂A最好选用____________________。
④试剂B与Mg( OH)2发生反应的化学方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)铝是地壳中含量最大的_____元素。金属铝具有很好的抗腐蚀性能,原因是铝在空气中____。铝的原子结构示意图为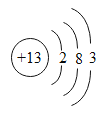 ,则Al3+的原子核内有___个质子 ,核外电子数为_____。
,则Al3+的原子核内有___个质子 ,核外电子数为_____。
(2)如图为氯化钠碳酸钠在水中的溶解度曲线。请回答下列问题:
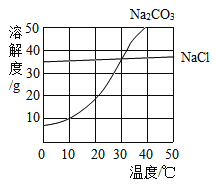
①10°C时,碳酸钠的溶解度为__g;30°C时,氯化钠的溶解度___碳酸钠的溶解度(填写“>”、“<”或“=”)。
②10°C时,向两只盛有100 g水的烧杯中,分别加入氯化钠、碳酸钠两种物质,至不再溶解为止,所得溶液的溶质质量分数大的是____溶液(填化学式)
③如图所示,20°C时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出。加入的物质可能是____(填字母序号)。
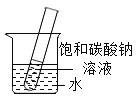
A 氢氧化钠
B 生石灰
C 浓硫酸
D 硝酸铵
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸二甲酯(C3H6O3)是一种具有重要应用价值和广阔市场前景的绿色化学试剂,熔点4°C、沸点90.1°C。常温下,它是一种无色透明、略有刺激性气味的液体,具有无毒、无腐蚀性、含氧量高、相溶性好的特点。下列有关说法中不正确的是
A.碳酸二甲酯被视为绿色化学试剂,跟它无毒、无腐蚀性有关
B.碳酸二甲酯分子中含有3个碳原子和3个水分子
C.碳酸二甲酯由碳、氢、氧三种元素组成
D.碳酸二甲酯的氧含量高达53.3%
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(NH)是氮和氢形成的一种化合物,易溶于水。工业上利用尿素法生产肼,同时得到副产品十水合碳酸钠,其工艺流程如下:
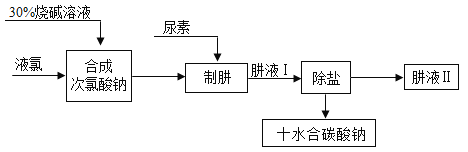
制肼过程的反应为:
![]()
(1)实验室若配制30%烧碱溶液,所需的玻璃仪器除玻璃棒外,还有_____(填标号)。
A 漏斗 B 烧杯 C 烧瓶 D 量筒
(2)已知:![]() 。请推测Cl2与NaOH溶液发生反应的化学方程式:_____;从后续反应过程来看,若要使原料不浪费,合成次氯酸钠时投入的液氯与烧碱的质量之比为71:_____。
。请推测Cl2与NaOH溶液发生反应的化学方程式:_____;从后续反应过程来看,若要使原料不浪费,合成次氯酸钠时投入的液氯与烧碱的质量之比为71:_____。
(3)实验室中,欲从母液中分离出十水合碳酸钠晶体。可采用的操作依次为_____(填标号)。
A 蒸馏 B 蒸发 C 灼烧 D 过滤 E冷却结晶
(4)肼具有很好的还原性,且还原产物无污染,故可用于除去锅炉等设备供水中的溶解氧等。请写出肼除氧时发生反应的化学方程式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F均为初中化学常见的物质,且均含同一种元素。B、C组成元素相同,D、E、F的水溶液均呈碱性,A为单质,F常用作改良酸性土壤。它们之间存在如图所示的转化关系,“一”表示两种物质之间可以相互反应,“→”表示一种物质可生成另一种物质。请回答下列问题:
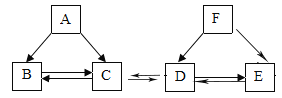
(1)A物质的名称是_____。
(2)F转化为E的化学方程式为_____。
(3)除去E中混有的少量D的方法是_____。
(4)C转化为B的基本反应类型为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋是个巨大的宝库,能给我们提供很多的能量和物质。
(1)2017年开采成功的可燃冰其主要成分为甲烷,实验室可以用无水醋酸钠(CH3COONa)和碱石灰混合加热的方法来制取该气体。
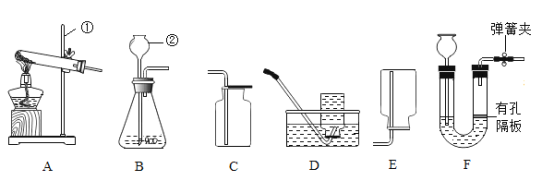
I、制取甲烷时应选择的发生装置为_____。
II、写出实验室制取甲烷的化学方程式_____。
III、若选择D收集甲烷,结束时,先把导管从水中取出的原因_____。
(2)从海水中获得的粗盐中含有NaCl、MgCl2、CaCl2、Na2SO4、泥沙等物质,粗盐中的难溶性杂质去除之后可获得精盐,为了从中提取氯化镁和氯化钠,设计实验方案如下:
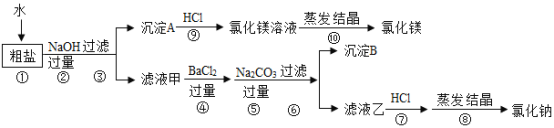
I、写出步骤⑨中反应的化学方程式_____。
II、步骤④⑤的顺序颠倒会导致什么后果?_____。
III、在步骤⑦中若加入的盐酸略过量是否对实验结果有影响,原因是什么?_____。
(3)用上面(2)中得到的精盐配制500g质量分数为0.9%的生理盐水,需要精盐的质量为_____,小明同学在量取水时俯视读数,他所配制的溶液的质量分数_____0.9%(填“>”“<”“=”)
(4)已知氯化镁固体电解可以得到单质镁和氯气,要制得96Kg的金属镁,需要氯化镁固体的质量为多少。_____
查看答案和解析>>
科目: 来源: 题型:
【题目】今年春天南方出现了H7N9禽流感,从香料八角中提取的莽草酸(C7H10O5)是合成治疗禽流感药物-达菲的原料。现有17.4g的莽草酸与一定量的氧气在点燃的条件下生成17.6g的:二氧化碳、9g的水和xg的CO。求x的值为_____,参加反应的氧气和莽草酸中的氧元素的质量比为_____,该反应的化学方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com