
科目: 来源: 题型:
【题目】在托盘天平的两盘分别放入质量相等的烧杯,烧杯中各盛放100g溶质质量分数为7.3%的稀盐酸,向两个烧杯中同时放入下列物质,反应停止后天平不平衡的是
A.5.6g铁 5.6g镁铝合金
B.2.4g镁 2.4g铝
C.10g碳酸钙 5.6g氧化钙
D.16.8gNaHCO3 16.8gMgCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】在“新型冠状病毒”的疫情防控过程中,常用“84消毒液”进行消毒。但如果将洁厕灵和“84消毒液”同时使用,则会发生如图所示的化学反应。下列说法正确的是( )
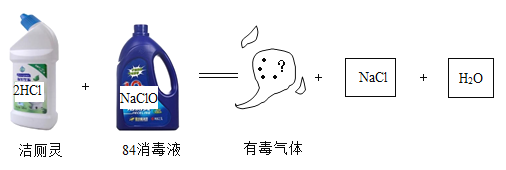
A.生成的有毒气体是ClO
B.反应物和生成物中,属于氧化物的有2种
C.该反应属于复分解反应
D.该反应中氯元素表现出3种化合价
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产的纯碱中常含有少量NaCl杂质。化学课外活动小组同学为测定该纯碱样品中碳酸钠含量是否符合如图的标签要求,他们称取了纯碱样品11g,全部溶解在64.4g水中,向该溶液中加入一定量的稀盐酸恰好完全反应,生成气体4.4克。若将溶液蒸发50克水后,所得溶液的溶质质量分数为10%。计算:

(1)通过计算判断该纯碱中碳酸钠含量是否符合标签要求?(精确到0.1%)
(2)蒸发水后所得溶液的质量。
(3)所用稀盐酸中溶质的质量分数。
查看答案和解析>>
科目: 来源: 题型:
【题目】无色晶体硫酸锌,俗称皓矾,在医疗上用作收敛剂、工业上作防腐剂、制造白色颜料(锌钡白)等。实验室通常用粗锌(含有铁等杂质)和稀硫酸反应制取氢气。为了充分利用制氢废液,某实验小组用制氢废液为原料制备硫酸锌晶体并探究其性质。
(制备硫酸锌晶体)
已知:①开始生成氢氧化物沉淀到沉淀完全的pH值的范围分别为:Fe(OH)3:2.7—3.7 Fe(OH)2:7.6—9.6 Zn(OH)2:5.7—8
②硫酸锌微溶于酒精
实验流程如图所示:

试回答下列问题:
(1)实验室制取氢气的原理_______ (用化学方程式表示)。
(2)溶液A中加入试剂①的目的是使FeSO4转化为Fe2(SO4)3,通常用过氧化氢溶液,该反应的化学方程式为![]() ,X的化学式为____________。
,X的化学式为____________。
(3)加试剂②的目的是使铁元素完全沉淀,加入试剂②最好选用_________。
A ZnO
B Zn(OH)2
C NaOH
D ZnSO4
(4)结晶操作的过程包括:蒸发浓缩、_________。
(5)最后一次过滤得到的晶体用酒精洗涤晶体而不用水洗的目的是_____。
(测定硫酸锌晶体ZnSO4·xH2O中结晶水的含量)
实验小组同学将回收到的皓矾晶体(ZnSO4·xH2O)用下面的装置测定晶体中结晶水的含量(图中半透膜可让气体通过又可防止固体粉末进入导管)。测定方法:称取28.7g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水:(![]() ),冷却至常温后,称量玻璃管中固体,其质量为16.1g。
),冷却至常温后,称量玻璃管中固体,其质量为16.1g。

(1)A中的化学方程式是_____,B中的试剂可从下列物质中选取,你的选择是_____。
A 浓硫酸
B 硝酸银溶液
C 饱和碳酸钠溶液
D 澄清石灰水
(2)实验过程中若不通入空气测得的结果将_______(填“偏大”或“偏小”或“无影响”)。根据实验结果,计算皓矾晶体中结晶水的x值为____________。(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯氧化铁可作为现代电子工业的材料,以下是硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:[(NH4)2CO3溶液呈碱性,40℃以上时(NH4)2CO3分解]。
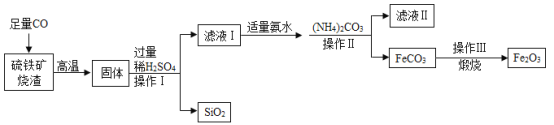

(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器玻璃棒、_______、烧杯等。
(2)写出通入CO后所发生反应的化学方程式_______(任意写一个)。
(3)在该生产流程中当加入(NH4)2CO3后,应该控制的条件是 ______ 。
(4)滤液Ⅱ中可回收的物质在农业上可做 _____
(5)写出在空气中煅烧FeCO3的化学方程式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学兴趣小组为检测出某工厂排出的浅蓝色、澄清透明废水中的离子,并加以综合处理。取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成;过滤,并将滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成;另一份滤液中加入氢氧化钠溶液,只产生蓝色沉淀。请回答。
(1)废水中一定含有的物质是________(选填编号)。
A、氯化物
B、硫酸盐
C、硝酸盐
D、碳酸盐
(2)该小组设计了从该废水中除去有毒离子的实验方案(如下图所示)。(已知:经实验测得废水样品的质量等于溶液B的质量,溶液C中仅含一种溶质;金属钡比金属钙活泼。)
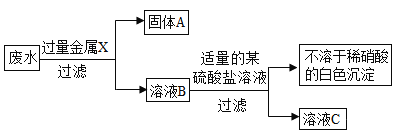
①写出符合题意的固体A的组成_________________(写化学式)。
②溶液B中的一定含有的溶质阳离子__________(写离子符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A~F均为初中化学常见的物质,已知A物质常用作食品干燥剂,F为常见的气体,D是一种红棕色固体,A、B、E、F属于不同类别的物质。它们之间的关系如图所示(“→”表示转化关系,部分反应及条件、反应物和生成物已略去),请回答下列问题:
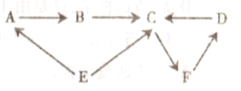
(1)C的化学式为_______________。
(2)写出B在农业上的一种用途___________。
(3)写出E→A的化学方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】结合下列实验装置图回答问题:

(1)①若实验室对你开放,请从图1(A-E)中选择合适的装置,制取一瓶较纯净的氧气。你选择的发生装置和收集装置的一套组合是________(填序号)。
②用图2装置研究二氧化碳的性质。看到的现象______________,可以验证CO2的性质是_____________。
(2)化学小组同学利用如图装置进行兴趣实验。若甲中放入块状大理石,乙中放入澄清石灰水,打开b,将分液漏斗中过量的盐酸注入,关闭a,你能看到的实验现象______________;一段时间后,关闭b,观察到乙中___________,产生此现象的原因是____________。

查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验装置图,回答有关问题:

(1)装置图中仪器a的名称为_____。
(2)用氯酸钾和二氧化锰混合制取氧气,可选用的发生装置是_____(填字母),写出该反应的化学方程式___。
(3)实验室用B装置制取二氧化碳的化学方程式为____,如果用G装置收集该气体,气体应从___(填“b”或“c”)端通入;用C装置代替B装置,收集所需的气体后,如果要使反应停止,则应对C装置进行的操作是_________。
(4)下图是为探究燃烧条件设计的实验:
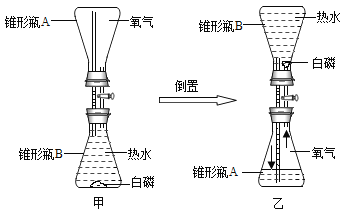
①该实验主要探究的是燃烧需要_______。
②该实验观察到的现象是_____。
③该实验所发生反应的化学方程式是_________。
④若用该装置测定空气中氧气体积分数约为五分之一,实验中应注意的事项有______(任意写一点)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用化学用语填空:保持氮气化学性质的最小粒子____________;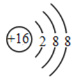 ____________。
____________。
(2)随着科学的发展,新能源的开发不断取得突破。清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如下(图中的微粒恰好完全反应)所示。请根据微观示意图回答以下问题。
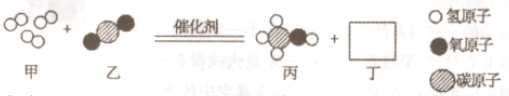
丁的化学式为____________,将二氧化碳转化成液体燃料甲醇可以减缓____________。
(3)我国化工专家侯德榜发明的“联合制碱法”为世界制碱工业做出了突出贡献。他以食盐、水、氨气、二氧化碳为原料,先制得碳酸氢钠和氯化铵,进而生产出纯碱。下表是几种物质在不同温度时的溶解度:
温度(℃) | 20 | 40 | 50 | 60 | |
溶解度/g | NaCl | 36.0 | 36.6 | 37.0 | 37.3 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | |
Na2CO3 | 21.8 | 48.9 | 47.5 | 46.5 | |
①20℃时,100克水中最多溶解Na2CO3____________克。
②60℃,分别取 Xg NaCl和XgNH4Cl固体加入两只烧杯中,进行如下实验。

加入甲烧杯中的固体是__________,甲烧杯中未溶解的固体最多有_____________g。
③下列说法正确的是________(填字母编号)。
A 该生产原料之一是饱和食盐水,室温下配制饱和食盐水的质量分数约为26.5%
B 生产中需通入氨气及二氧化碳,若要提高这些气体的溶解度,可通过增加水量来提高
C NH4C1和NaC1混合溶液中可以通过蒸发结晶的方法获得较多的NH4C1晶体
D “联合制碱法”得到的产品之一NH4Cl可作为氮肥使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com