
科目: 来源: 题型:
【题目】有三瓶无色、无味的气体A、B、C,它们分别是甲烷、氢气、一氧化碳中的一种。分别点燃三种气体,用干冷的烧杯罩在火焰上方,在B、C火焰上方的烧杯壁上有水滴出现,而A火焰上方的烧杯壁上没有水滴。燃烧后分别向烧杯中注入澄清的石灰水,振荡,A、B烧杯内的石灰水变浑浊,C烧杯内没有变化。则三种气体分别是A_______B________C________(写化学式),写出B物质燃烧的化学方程式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】校化学课外小组的同学,利用塑料瓶(质软)设计了如图所示的实验。请你根据生活经验及所学的知识,结合实验回答下列问题:
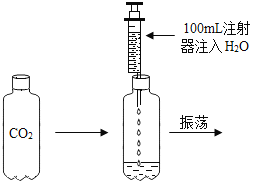
(1)请你分析并推测振荡后塑料瓶将发生什么变化?____
(2)发生该变化的原因是什么?____
(3)由此实验你可得出什么结论?_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】双氧水常用于消毒、漂白等方面,在二氧化锰的作用下可迅速分解放出氧气。张老师和化学小组的同学们按如图所示的装置实验。请回答:
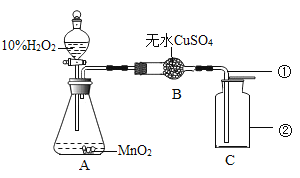
(1)锥形瓶内装有二氧化锰和双氧水,请写出锥形瓶中发生反应的化学方程式:_______,反应中二氧化锰起________作用。
(2)白色的无水硫酸铜遇水蒸气会变蓝,反应式为CuSO4 + 5H2O = CuSO45H2O(蓝),请预测本实验过程中无水硫酸铜是否会变蓝______(填〝是〞或〝否〞)。
(3)用向上排空气法收集得到氧气,图中仪器①插入仪器②的位置是否正确?____ (填〝是〞或〝否〞)。
(4)证明C中氧气已收集满的方法是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为实验室用CO还原CuO的装置示意图,试回答下列问题:
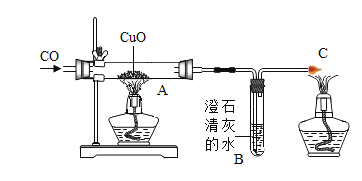
(1)在给CuO加热前,先通一会CO气体,其目的是赶走玻璃管中留存的空气,以防止______ 。
(2)在A处观察到的现象是_________,反应的方程式是________。B处观察到的现象是_____,反应的方程式是 ________。
(3)C处尾气必须点燃处理,目的是________。
(4)实验结束时,先撤去A处酒精灯,还要继续通入CO至玻璃管冷却,目的是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,水槽内盛有少量新制的澄清石灰水,点燃蜡烛,用玻璃钟罩将其扣在水槽内,观察到蜡烛_______________,原因是_________________;在这个实验中还观察到________、___________ ,原因是______________________、_______________。
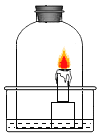
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组利用如图所示装置(图中固定装置已略去)测定铜锌合金中锌的质量分数,探究过程如下:
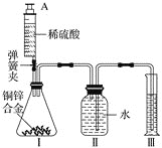
①连接实验装置并检查装置气密性。
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL(注:样品中的杂质不参加反应
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量为1.4g
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09gL-1。
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为___,实验过程中须加入稀硫酸至不再产生气体,目的是___。
(2)步骤③中称量剩余固体之前的正确操作是_______、洗涤、干燥。
(3)根据实验测定的数据,上述三位同学中________(填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数。
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差。以下因素可能造成偏差的有________(填标号)。
A 移出装置Ⅲ时,导管内留存了一部分水
B 实验测量前,没有排除装置Ⅰ中的空气
C 数据处理时,未排除加入稀硫酸所占的体积
【答案】(1)![]() ;使样品中的锌完全反应;(2)过滤;(3)乙;(4)AC;
;使样品中的锌完全反应;(2)过滤;(3)乙;(4)AC;
【解析】
试题(1)由于铜排在了氢的后面,所以与酸不反应,反应物是锌和硫酸,生成物是硫酸锌和氢气,氢气后面标上上升符号;实验过程中须加入稀硫酸至不再产生气体,目的是使样品中的锌完全反应;(2)从铜和硫酸锌溶液的混合物中得到铜,先进行过滤,得到带有硫酸锌溶液的铜,再进行洗涤除去表面的硫酸锌,再进行干燥除去水即可;(3)根据加入稀硫酸的量进行计算需要知道稀硫酸的溶质质量分数,而题中没有告知;(4)由于锌与硫酸反应生成硫酸锌和氢气时,放出热量,如果没等冷却到室温,根据热涨冷缩的原理可知进入量筒中水偏多,所以误认为得到的氢气多,再就是数据处理时,未排除加入稀硫酸所占的体积,计算的结果就偏大;
考点:金属的化学性质;化学方程式;实验误差分析;
点评:熟记金属活动性顺序表,知道排在氢之前的金属和稀盐酸或者硫酸反应生成氢气,而排中氢之后的金属和稀盐酸或者稀硫酸不生成氢气;化学反应中物质的质量比都是纯净物之间的质量比,而溶液中溶质的质量=溶液质量×溶质质量分数;本题容易出错的地方是对实验结果的评价,要知道锌与硫酸反应放出热量,会造成相应的误差,必须冷却到室温才能进行观察和计算。
【题型】实验题
【结束】
30
【题目】用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
查看答案和解析>>
科目: 来源: 题型:
【题目】金属材料在生产、生活中有广泛的应用,人类的生产和生活都离不开金属。
(一)铁的应用和防护
(1)常州地铁的轨道主要材料是铁合金制作的,其硬度比纯铁________。
(2)钢铁的锈蚀主要是铁与空气中的_________等物质发生化学反应的结果。
(3)为防止铁生锈,通常会对铁制品进行“烤蓝”处理,烤蓝是用化学方法在铁表面生成层致密的四氧化三铁(Fe3O4)保护膜。烤蓝的原理是:在高温下,铁与水发生反应,生成四氧化三铁和一种单质气体,写出该反应的化学反应方程式:_______。
(二)铁的冶炼
我国劳动人民在春秋战国时期就会治铁炼钢,实验室模拟炼铁实验装置如下图所示。
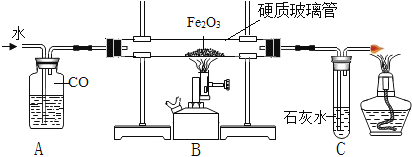
(1)实验时,应先注水片刻后再加热的目的是___________。
(2)实验过程中,硬质玻璃管中发生的化学方程式为___________。
(3)有同学提出黑色粉末中还可能含有Fe3O4。已知:Fe3O4能溶于稀H2SO4,且有Fe3+生成;Fe3+遇到硫氰化钾溶液显血红色。为证明黑色粉末成份,该同学取少量样品于烧杯中,加过量稀H2SO4,充分反应后,滴加少量硫氰化钾,证明黑色粉末中含有Fe和Fe3O4的现象是_________。
(4)若取16g氧化铁粉末进行实验,反应一段时间后,经检测剩余黑色固体成份是Fe和Fe3O4,称量固体的质量为X,则X的范围为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.实验室用块状大理石和5%的稀盐酸反应制取CO2,观察不到气泡产生时,发现固体还有剩余,对此进行探究(大理石中的杂质不溶于水且不与酸反应)。
(提出问题)不再产生气泡的原因是什么?
(猜想假设)猜想一:剩余固体中无碳酸钙。猜想二:______。猜想三:生成物或杂质附着在大理石表面,阻碍反应继续进行。
(实验探究)剩余固体中是否有碳酸钙。
某同学先振荡反应容器,使剩余固体和液体充分接触,观察到仍无气泡产生;再向容器中滴加少量5%的稀盐酸,又有气泡产生。一段时间后,不再产生气泡,仍有固体剩余。产生气泡的化学方程式是_______。
(得出结论)
由以上实验可知,猜想一和猜想三________选填:“成立”“不成立”或“无法确定”)
Ⅱ.某兴趣小组利用传感器对二氧化碳性质再探究。实验步骤如下:
(1)如图1所示装置的气密性良好,三瓶250mL的烧瓶内收集满CO2气体,三个注射器内各装有85mL的液体(分别是水、饱和石灰水、40%的氢氧化钠溶液)。连接好装置和压强传感器。
(2)三位同学同时迅速将注射器内液体全部注入各自烧瓶中。
(3)一段时间后,同时振荡烧瓶,电脑记录烧瓶内气压随时间变化如图2所示。(瓶1、瓶2、瓶3对应的曲线是曲线1、曲线2、曲线3)
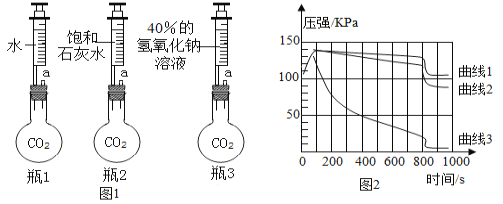
试回答下列问题:
①导致曲线1中CD段气压急速减小的操作是____________。不改变装置药品的情况下,进一步降低E点的方法是____________。
②曲线2中发生的主要化学反应方程式为_____________。
③对比曲线1、2、3,不能得出的结论是______(选填字母)。
A CO2能与水发生反应生成碳酸 B CO2能与NaOH溶液发生反应
C 检验CO2用饱和澄清石灰水较合适 D 吸收CO2用NaOH溶液较合适
查看答案和解析>>
科目: 来源: 题型:
【题目】产品(CuCl)广泛应用于化学工业生产。CuC1是一种白色固体,难溶于乙醇和水,可溶于氯离子浓度较大的溶液,在潮湿空气中易氧化变质。以硫化铜精矿为原料生产CuC1的工艺过程如下图所示:
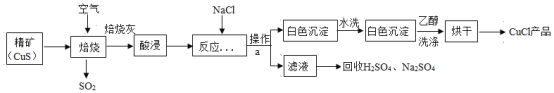
信息提示:(1).酸浸时发生的反应:CuO+H2SO4== CuSO4+H2O;(2).乙醇与水任意比互溶;(3).乙醇与CuC1不发生化学反应。
(1)产品CuCl中铜的化合价是____________。
(2)焙烧前对精矿进行粉碎,其目的是_________。
(3)CuS精矿经250℃低温培烧后生成CuO,该步骤中反应的化学方程式是________。
(4)操作a的名称是_________;进行该操作时玻璃棒的作用是________;本流程中可以循坏利用的物质(水除外)是___________(写化学式)。
(5)用“水洗”的目的是_____________,“乙醇洗涤”的目的是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图回答:
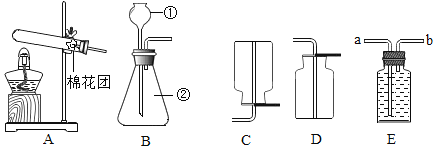
(1)写出所标仪器的名称:①是___________。
(2)用高锰酸钾制取O2,反应的化学方程式为__________,发生装置应选___________(填序号);若用E装置收集O2,则O2应从________(“a”或“b”)端通入。
(3)若用D装置收集O2,验满方法是____________。
(4)若用过氧化氢溶液制备氧气,实验时需要1.6g氧气,至少需要加入多少克5%的过氧化氢溶液_________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com