
【题目】能够正确表示下列变化的离子方程式是
A.醋酸钠的水解:CH3COOH+H2OCH3COO+H3O+
B.电解熔融MgCl2:Mg2++2Cl![]() Mg+Cl2↑
Mg+Cl2↑
C.MnO2 与浓盐酸共热:MnO2+4HCl![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.K2S溶液中滴加几滴FeCl3溶液:![]()
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如下图实验可检验某食品中亚硫酸盐含量(所加试剂均足量)。下列说法不正确的是

A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“环境就是民生,青山就是美丽,蓝天也是幸福。“拥有天蓝、地绿、水净的美好家园,是每个中国人的梦想。回答下列问题:
(1)排放到大气中的氮的氧化物,会造成___污染。
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氨废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以NH4+和NH3·H2O形式存在,为达到变废为宝回收利用的目的。可采取的方法是___。
②某团队设计处理流程如下:
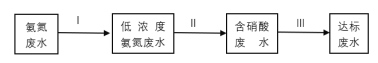
过程Ⅱ为硝化过程,在微生物的作用下实现NH4+→NO2-→NO3-的转化,在碱性条件下NH4+被氧气氧化成NO3-的总反应离子方程式为___。
过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→NO2-→N2的转化,将lmol NO2-完全转化为N2,转移的电子数为___。
(3)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为____。
②某兴趣小组对取得的酸雨样品进行pH测定,随着的简的推移,得到以下数据(pH越小,酸性越强)。
时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
雨水pH变化的主要原因是___(用化学方程式表示)。
③某硫酸化工厂,使用一种含杂质为25%的黄铁矿石(FeS2)为原料。若取2吨该矿石,可制得98%的浓硫酸___吨(假设生产过程中96%SO2转化为SO3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将稀HCl溶液滴加到等浓度的弱碱AOH溶液中,测得混合液的pH和![]() 的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法错误的是( )
的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法错误的是( )
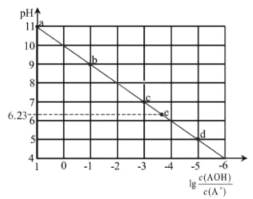
A.常温下,A+的水解平衡常数为1.0×10-10
B.点d溶液中:c(Cl-)> c(AOH)>c(A+)
C.点c 溶液中的n(A+)+n(AOH)等于点e溶液中的n(Cl-)
D.点e溶液中水电离出的H+浓度为10-6.23 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。 某兴趣小组制备 KH2PO4,流程如下:

已知:
a.KH2PO4 有潮解性,溶于水,不溶于乙醇和醚等有机溶剂。
b.HCl 易溶于乙醇和醚等有机溶剂。
请回答:
(1)步骤Ⅱ的实验操作是_____。
(2)有关步骤Ⅲ,下列说法正确的是_____。
A.有机溶剂 M 可用乙醇
B.步骤Ⅲ与步骤Ⅱ的实验操作基本相同
C.NH4Cl 在水中溶解度明显大于在有机溶剂 M 中
D.有机溶剂 M 可循环使用
(3)试从平衡角度分析,由步骤Ⅰ、Ⅱ得到 KH2PO4 溶液的原理:_____。
(4)在下列仪器中,使用前需进行“检漏”操作的是_____。
A.吸滤瓶 B.球型分液漏斗 C.蒸馏烧瓶 D.碱式滴定管
(5)步骤Ⅳ,包括蒸发浓缩、冷却结晶、过滤、干燥等多步操作。在冷却结晶操作中,为了得到 磷酸二氢钾大晶体,常采取的措施有____________________。某同学发现使用加热浓缩、冷却结晶得到的磷酸二氢钾晶体欠佳,请提出针对性的改进实验方案:_____________,然后经过滤、干燥得到晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法不正确的是
A.1mol CH4 与 Cl2 在光照下反应生成的CH3Cl分子数等于NA
B.100 g CaCO3 和 KHCO3 的固体混合物中含有的阳离子数为 NA
C.一定浓度的硫酸和镁反应,生成 11.2L(标准状况)气体,转移电子数为 NA
D.6.4g SO2 溶于水形成的酸雨中,SO2、H2SO3、HSO![]() 和 SO
和 SO![]() 的微粒数之和为 0.1NA
的微粒数之和为 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}为原料制取硝酸银晶体,其实验流程如下:

已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
③PbCl2、AgNO3的溶解度曲线如图所示:

(1)“滤液”中的主要阳离子为___(填化学式)。
(2)“除杂”分为两步:先除去PbCl2,再除去Ag2S。
①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为______,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是_______。
(3)室温下,可逆反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数K=___。{Ksp(AgCl)= 1.8×10-10,Ag++2NH3·H2O[Ag(NH3)2]++2H2O的平衡常数为1.1×107}
(4)“还原”过程中发生反应的离子方程式为_____ 。
(5)粗银经水洗后,经多步处理可制备硝酸银晶体。请补充完整由以水洗后粗银为原料,制备硝酸银晶体的实验方案:________,过滤,________,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液_______,过滤,将所得晶体置于烘箱 (120℃)干燥,密封包装。(实验中须使用的试剂:稀硫酸、稀硝酸、BaC12溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取1 mL 0.1 mol·L-1 AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1 mol·L-1):

下列说法不正确的是
A. 实验①白色沉淀是难溶的AgCl B. 由实验②说明AgI比AgCl更难溶
C. 若按①③顺序实验,看不到黑色沉淀 D. 若按②①顺序实验,看不到白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法匹拉韦(Favipiravir)是一种RNA聚合酶抑制剂,被用于治疗新型和复发型流感,主要通过阻断病毒核酸复制的方法抑制病毒增殖,其结构如图。下列关于法匹拉韦的说法错误的是( )
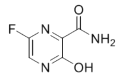
A.分子式为C5H4FN3O2
B.所有原子可能在同一平面上
C.所有碳原子的杂化方式都是sp2杂化
D.一定条件下能与氢氧化钠溶液、盐酸、氢气等发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com