
【题目】“环境就是民生,青山就是美丽,蓝天也是幸福。“拥有天蓝、地绿、水净的美好家园,是每个中国人的梦想。回答下列问题:
(1)排放到大气中的氮的氧化物,会造成___污染。
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氨废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以NH4+和NH3·H2O形式存在,为达到变废为宝回收利用的目的。可采取的方法是___。
②某团队设计处理流程如下:
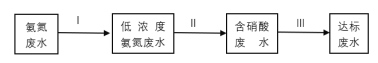
过程Ⅱ为硝化过程,在微生物的作用下实现NH4+→NO2-→NO3-的转化,在碱性条件下NH4+被氧气氧化成NO3-的总反应离子方程式为___。
过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→NO2-→N2的转化,将lmol NO2-完全转化为N2,转移的电子数为___。
(3)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为____。
②某兴趣小组对取得的酸雨样品进行pH测定,随着的简的推移,得到以下数据(pH越小,酸性越强)。
时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
雨水pH变化的主要原因是___(用化学方程式表示)。
③某硫酸化工厂,使用一种含杂质为25%的黄铁矿石(FeS2)为原料。若取2吨该矿石,可制得98%的浓硫酸___吨(假设生产过程中96%SO2转化为SO3)。
【答案】光化学烟雾 加入氢氧化钠溶液并加热将氨气赶出回收(或加入氢氧化钠溶液并加热将氨气赶出回收,或加入硫酸制成氮肥硫酸铵(答案合理即可) ![]() 3NA 2SO2+O2+2CaCO3=2CaSO4+2CO2 雨水样品中的SO2和H2SO3不断被空气中的氧气氧化生成强酸(H2SO4),所以pH随时间的延长,H+浓度增大,pH下降,到全部氧化后,溶液中形成H2SO4不会继续氧化和挥发,pH不再发生变化 2.4t
3NA 2SO2+O2+2CaCO3=2CaSO4+2CO2 雨水样品中的SO2和H2SO3不断被空气中的氧气氧化生成强酸(H2SO4),所以pH随时间的延长,H+浓度增大,pH下降,到全部氧化后,溶液中形成H2SO4不会继续氧化和挥发,pH不再发生变化 2.4t
【解析】
(1)氮的氧化物,会造成光化学烟雾污染;
(2)①NH4+和NH3·H2O可转化成硝酸、氨气或氮肥硫酸铵等回收利用,据此分析;
②在碱性条件下NH4+被氧气氧化成NO3-,同时氧气被还原成H2O,据此分析;
(3)①向燃煤中加入CaCO3浆状物进行脱硫制石膏,是二氧化硫、碳酸钙及氧气反应生成了CaSO4和CO2,据此分析;
②雨水样品中的SO2和H2SO3,不断被空气中的氧气氧化生成强酸(H2SO4),全部氧化后,溶液中形成H2SO4不会继续氧化和挥发,据此分析;
③由黄铁矿制备硫酸的过程为:FeS2~2SO2~2SO3~2H2SO4,依据硫原子个数守恒找到FeS2与H2SO4的关系进行计算;
(1)排放到大气中的氮的氧化物,会造成光化学烟雾污染,
故答案为:光化学烟雾;
(2)①氨氮废水中的氮元素多以NH4+和NH3·H2O形式存在,为达到变废为宝回收利用的目的,可往废水中加入氧化剂氧化成硝酸回收利用,或加入氢氧化钠溶液并加热将氨气赶出回收,或加入硫酸制成氮肥硫酸铵,(答案合理即可)
故答案为:加入氢氧化钠溶液并加热将氨气赶出回收(或加入氧化剂氧化成硝酸回收利用,或加入硫酸制成氮肥硫酸铵(答案合理即可);
②过程Ⅱ为硝化过程,在微生物的作用下实现NH4+→NO2-→NO3-的转化,在碱性条件下NH4+被氧气氧化成NO3-的总反应离子方程式为:![]() ;
;
过程Ⅲ向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→NO2-→N2的转化,将lmol NO2-完全转化为N2时,NO2-的氮元素由为+3价转化为N2中的 0价,根据原子守恒可知转移的电子数为3mol,即转移的电子数为3NA,
故答案为:![]() ;3NA;
;3NA;
(3)①向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏,说明煤燃烧产生SO2和CaCO3反应生成了石膏CaSO4,反应的方程式为:2SO2+O2+2CaCO3=2CaSO4+2CO2,
故答案为:2SO2+O2+2CaCO3=2CaSO4+2CO2;
②雨水样品中的SO2和H2SO3,不断被空气中的氧气氧化生成强酸(H2SO4),所以pH随时间的延长,H+浓度增大,pH下降,到全部氧化后,溶液中形成H2SO4不会继续氧化和挥发,pH不再发生变化,
故答案为:雨水样品中的SO2和H2SO3不断被空气中的氧气氧化生成强酸(H2SO4),所以pH随时间的延长,H+浓度增大,pH下降,到全部氧化后,溶液中形成H2SO4不会继续氧化和挥发,pH不再发生变化;
③依据反应前后硫元素质量不变可知:FeS2~2SO2~2SO3~2H2SO4,设制备浓硫酸的质量为m,生产过程中96%SO2转化为SO3,则
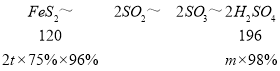 ,
,
![]()
![]()
![]()
![]() ,解得m
,解得m
故答案为:2.4t。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物是日常生活中的常用调味品。回答下列问题:
(1)五种元素中,原子半径最大的是________,非金属性最强的是________(填元素符号)。
(2)由A分别和B、D、E所形成的共价型化合物中,热稳定性最差的是__________(用化学式表示)。
(3)A、B、E形成的离子化合物电子式为____________,其中存在的化学键类型为____________。
(4)D最高价氧化物的水化物的化学式为________________。
(5)单质D在充足的单质E中燃烧,反应的化学方程式为__________________;D在不充足的E中燃烧,生成的主要产物的化学式为__________。
(6)单质E与水反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅用下表提供的用品(夹持仪器和试剂任选)能实现相应实验目的的是( )
选项 | 实验目的 | 仪器 |
A | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
B | 除去氢氧化铝胶体中的泥沙 | 半透膜、烧杯、玻璃棒 |
C | 用0.1000mol/L盐酸测定未知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
D | 中和热的测定 | 烧杯、温度计、环形玻璃搅拌棒、泡沫塑料、硬纸板 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定实验。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5 mol·L-1盐酸、0.55 mol·L-1氢氧化钠溶液,实验尚缺少的玻璃用品是___、___。
(2)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
a | 50mL 0.55mol·L-1NaOH溶液 | 50mL0.5mol·L-1HCl溶液 | 20℃ | 23.3℃ | ___ |
b | 50 mL0.55mol·L-1 NaOH溶液 | 50mL0.5mol·L-1 HCl溶液 | 20℃ | 23.5℃ | |
已知:反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1g·cm-3。计算完成表中ΔH=___。
(3)___(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。
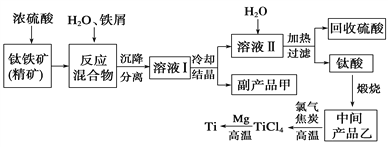
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为____________________。
(2)上述生产流程中加入铁屑的目的是_________________________,此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。除去所得金属钛中少量的金属镁可用的试剂是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,《自然—通讯》发表了我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是___,能量最低的是___(用字母表示)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有___种。
(3)Na与N形成的NaN3可用于制造汽车的安全气囊,其中阴离子的空间构型为___,Na在空气中燃烧则发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为___光谱(填“发射”或“吸收”)。
(4)已知NH3分子的键角约为107°,而同主族磷的氢化物PH3分子的键角约为94°,试用价层电子对互斥理论解释NH3的键角比PH3的键角大的原因:___。
(5)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供___,在BH3·NH3中B原子的杂化方式为___。它的性质与乙烷有所不同:在标准状况下为无色无味的白色固体,在水中溶解度也较大,其原因是___。
(6)立方氮化硼属于原子晶体,其晶胞结构如图1所示,可认为氮原子处于硼原子围成的某种空隙中,则氮原子处于硼原子围成的___(填空间结构)空隙中。图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”标明N的相对位置___。
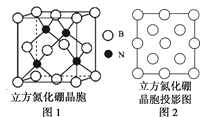
已知立方氮化硼的密度为dg·cm-3,阿伏加德罗常数的值为NA,则晶胞中硼原子与氮原子的最近距离为___nm。(只要求列算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式属于水解反应方程式的是( )
A.H2CO3![]() HCO3-+H+B.HCO3-+H2O
HCO3-+H+B.HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C.HCO3-+OH-=H2O+CO32-D.CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够正确表示下列变化的离子方程式是
A.醋酸钠的水解:CH3COOH+H2OCH3COO+H3O+
B.电解熔融MgCl2:Mg2++2Cl![]() Mg+Cl2↑
Mg+Cl2↑
C.MnO2 与浓盐酸共热:MnO2+4HCl![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.K2S溶液中滴加几滴FeCl3溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M的结构简式如下,在足量NaOH水溶液中加热,然后用足量盐酸酸化后得到三种不同的有机物A、B、C,且A、B、C中所含碳原子数依次增加。回答下列问题:
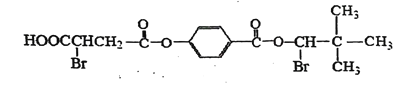
已知:同一个碳原子上结合两个羟基会自动脱水生成醛基。
(1) 1mol M加热条件下与足量的NaOH水溶液反应,消耗NaOH的物质的量为___。
(2) B中含有的官能团名称为____。
(3) C不能发生的反应类型有____。(填序号)
①加成反应②消去反应③显色反应④取代反应
(4)A在浓H2SO4作用下可生成六元环状化合物,其化学方程式为___。
(5)A的两种同分异构体E、F分别有如下特点:
①lmol E或F可以和3mol Na发生反应,放出标准状况下33.6L H2;
②lmol E或F可以和足量NaHCO3溶液反应,生成lmol CO2;
③lmol E或F可以发生银镜反应,生成2mol Ag。
则E和F的结构简式分别是_____、_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com