
【题目】金属氟化物一般都具有高容量、高质量密度的特点。氟离子热电池是新型电池中的一匹黑马,其结构如图所示。下列说法正确的是
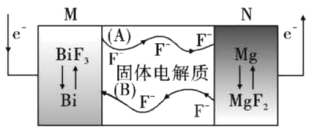
A. 图示中与电子流向对应的氟离子移动方向是(B)
B. 电池放电过程中,若转移1mol电子,则M电极质量减小12g
C. 电池充电过程中阳极的电极反应式为:B+3F--3e-=BiF3
D. 该电池需要在高温条件下工作,目的是将热能转化为电能
科目:高中化学 来源: 题型:
【题目】氰化钠被广泛用于电镀、金的提取以及有机合成中,但含氰废水属于高毒类,必须对其进行处理。
(1)向NaCN溶液中通入CO2能发生反应:NaCN+H2O+CO2=HCN+NaHCO3,说明酸性:HCN__________H2CO3(填“>”或“<”)。
(2)含CN-浓度较低的废水可直接用FeSO4·7H2O处理,得到一种蓝色沉淀M,M的摩尔质量为592 g·mol-1,则M的化学式为___________________。
(3)pH在7.510之间且铜作催化剂的条件下,用SO2-空气处理含氰废水会生成NH3、碳酸氢盐及硫酸盐,已知参与反应的SO2与O2的物质的量之比为1∶1,则该反应的离子方程式为______________。
(4)工业上常用碱性氯化法处理含氰废水,其原理如下图所示:

①第一阶段的中间体CNCl中碳元素的化合价为__________________。
②某工厂含氰废水中NaCN的含量为14.7 mg·L-1,处理10m3这样的废水,理论上需要5 mol·L-1 NaClO溶液____________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3-甲基-3-羟甲基氧杂环丁烷 可用于制备多种化工原料。下列有关该有机物的说法正确的是( )
可用于制备多种化工原料。下列有关该有机物的说法正确的是( )
A.分子式为C4H8O2
B.与环氧乙烷(![]() )互为同系物
)互为同系物
C.与其互为同分异构体(不含立体结构)的羧酸有4种
D.分子中所有碳原子处于同—平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 NA是阿伏加德罗常数的值。下列说法正确的是
A.1L1mol/L葡萄糖水溶液中含H-O键的数目为5 NA
B.标准状况下,2.24LCO2和N2O的混合气体所含质子数为2.2 NA
C.1molCH3COOH和3molCH3CH2OH在浓硫酸催化下反应生成酯基的数目为NA
D.常温下,28g铁片投入足量浓硝酸中,转移电子数为1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Ⅰ( )是一种新型感光高分子化合物,工业上合成它的一种路线图如下,图中C、D也是高分子化合物且D具有强的亲水性,反应①中C2H2发生了加成反应,烃E的质谱图中质荷比最大值为92,G能发生银镜反应。又知同一个碳原子上若连接有2个或3个羟基时,自动脱去一个水分子。
)是一种新型感光高分子化合物,工业上合成它的一种路线图如下,图中C、D也是高分子化合物且D具有强的亲水性,反应①中C2H2发生了加成反应,烃E的质谱图中质荷比最大值为92,G能发生银镜反应。又知同一个碳原子上若连接有2个或3个羟基时,自动脱去一个水分子。

(1)A的结构简式为____________,E的名称是___________________,③的反应类型是________。
(2)B中官能团的名称是____________,C的结构简式为______________。
(3)写出反应④的化学方程式:_________________。
(4)X是H的芳香族同分异构体,X具有如下性质,能发生银镜反应且1molX与足量银氨溶液反应时可得到4molAg,则X共有______________种,写出一种核磁共振氢谱有4组峰的同分异构体的结构简式_______________。
(5)以乙苯、乙炔为基本原料制备苯乙酸乙烯酯(![]() ),写出其合成路线图:_____________。
),写出其合成路线图:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2一氨-3—氯苯甲酸是白色晶体,其制备流程如下:
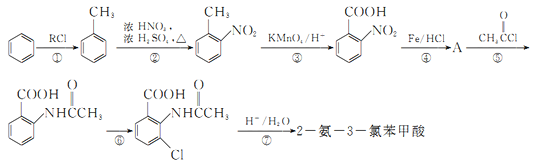
已知: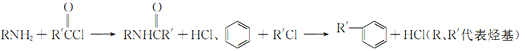
回答下列相关问题
(1)![]() 的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
(2)反应①中R代表的是_____________,反应②的反应类型为_____________。
(3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式_____________。
(4)A的结构简式为_____________,⑥的反应条件为_____________。
(5)符合下列条件的同分异构体的结构简式为_____________。
a.式量比![]() 大42的苯的同系物;
大42的苯的同系物;
b.与酸性KMnO4反应能生成二元羧酸
c.仅有3种等效氢
(6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。
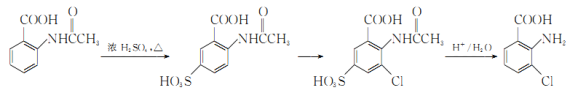
分析产率提高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值。下列判断正确的是( )
A.46g的NO2和N2O4的混合物所含原子总数为3NA
B.24g Mg变为Mg2+时失去的电子数目为NA
C.1mol/L CaCl2溶液中含有的Cl-离子数目为2NA
D.含有lmol FeCl3的溶液加热中完全转化为氢氧化铁胶体,其中胶粒的数目为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 20 mL 0.2 mol/LH2A溶液中滴加0. 2 mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示(其中I代表H2A.,II代表HA—,III表A2—)。根据图示.判断下列说法正确的是

A.当V(NaOH)=20 mL时.溶液中各离子浓度的大小关系为c(Na+)>c(HA—)>c(H+)>c(A2一)>c(OH—)
B.等体积、等物质的量浓度的NaOH溶液与H2 A溶液混合后,其溶液中水的电离程度比纯水中的大
C.NaHA溶液中:c(OH—)+2c(A2—) =c(H+) +c(H2A )
D.将Na2A溶液加水稀释.溶液中所有离子的浓度都减小.但部分离子的物质的量增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com