
【题目】常温下,向 20 mL 0.2 mol/LH2A溶液中滴加0. 2 mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示(其中I代表H2A.,II代表HA—,III表A2—)。根据图示.判断下列说法正确的是

A.当V(NaOH)=20 mL时.溶液中各离子浓度的大小关系为c(Na+)>c(HA—)>c(H+)>c(A2一)>c(OH—)
B.等体积、等物质的量浓度的NaOH溶液与H2 A溶液混合后,其溶液中水的电离程度比纯水中的大
C.NaHA溶液中:c(OH—)+2c(A2—) =c(H+) +c(H2A )
D.将Na2A溶液加水稀释.溶液中所有离子的浓度都减小.但部分离子的物质的量增加
【答案】A
【解析】
A、当V(NaOH)=20mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,由图象看出c(A2-)>c(H2A),说明HA-电离大于水解,溶液呈酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),选项A正确;
B.等体积等浓度的NaOH溶液与H2A溶液混合后生成NaHA,溶液呈酸性,则抑制水的电离,溶液中水的电离程度比纯水中的小,选项B错误;
C、根据质子守恒可知,NaHA溶液中: c(OH一)+c(A2—) =c (H +) +c(H2A ),选项C错误;
D、因对强碱弱酸盐溶液稀释,c(H+)增大,则将该电解质溶液加水稀释,溶液中离子浓度不一定都减小,选项D错误;
答案选A。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】金属氟化物一般都具有高容量、高质量密度的特点。氟离子热电池是新型电池中的一匹黑马,其结构如图所示。下列说法正确的是
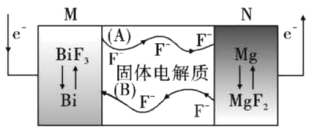
A. 图示中与电子流向对应的氟离子移动方向是(B)
B. 电池放电过程中,若转移1mol电子,则M电极质量减小12g
C. 电池充电过程中阳极的电极反应式为:B+3F--3e-=BiF3
D. 该电池需要在高温条件下工作,目的是将热能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“暖冰”是科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。用“暖冰”做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液呈血红色。则下列说法不正确的是( )
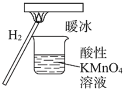
A.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧的产物中可能含有一定量的H2O2
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
A. 加入合金的质量不可能为6.4 g
B. 参加反应的硝酸的物质的量为0.1 mol
C. 沉淀完全时消耗NaOH溶液的体积为150 mL
D. 溶解合金时收集到NO气体的体积在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是
A. 11.2 L 甲烷和乙烯的混合物中含氢原子数目等于2NA
B. 含NA个 CO32-的 Na2CO3溶液中,Na+数目大于2NA
C. 密闭容器中,2 molSO2和足量 O2充分反应,产物的分子数小于2NA
D. 4.0 g CO2气体中含电子数目等于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物c的制备原理如下:
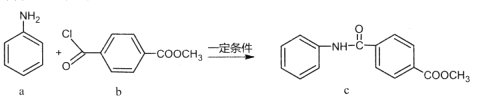
下列说法正确的是
A.该反应为加成反应B.化合物a中所有原子一定共平面
C.化合物C的一氯代物种类为5种D.化合物b、c均能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶物氢化亚铜(CuH)可用CuSO4溶液和“另一种反应物”在40℃~50℃时反应生成.CuH不稳定,易分解;CuH在氯气中能燃烧;常温下跟盐酸反应能产生气体,以下有关它的推断中不正确的是()
A.“另一种反应物”一定具有氧化性B.CuH既可做氧化剂也可做还原剂
C.2CuH + 3Cl2![]() 2CuCl2 + 2HCl↑D.CuH+HCl=CuCl↓+H2↑
2CuCl2 + 2HCl↑D.CuH+HCl=CuCl↓+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预测21世纪中叶将进入“氢能经济”时代,下列物质都是具有广阔应用前景的储氢材料。回答下列问题:
(1)Zr(锆)在元素周期表中位于第五周期,与钛同族,基态Zr的价层电子排布式为_______。
(2)亚氨基锂(Li2NH) 所含元素第一电离能最小的是____ ,电负性最大的是_____ (填元素符号)。
(3)咔唑(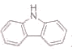 )的沸点比芴(
)的沸点比芴(![]() )高的主要原因是________。
)高的主要原因是________。
(4)①NH3BH3 (氨硼烷,熔点104℃)与乙烷互为等电子体。NH3BH3的晶体类型为____。其中B的杂化类型为____,可通过_________测定该分子的立体构型。
②NH3BH3可通过环硼氨烷、CH4与H2O进行合成,键角: CH4______H2O (填“> "或“<"),原因是________。
(5)MgH2晶体属四方品系,结构如图,晶胞参数a =b= 450pm, c= 30lpm,原子坐标为A(0,0,0)、B(0.305,0.305,0)、C(1,1,1)、D(0.195,0.805,0.5)。
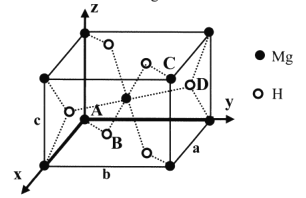
①Mg2+的半径为72pm,则H+的半径为______pm (列出计算表达式)
②用NA表示阿伏加德罗常数,MgH2晶体中氢的密度是标准状况下氢气密度的_____倍(列出计算表达式,氢气密度为0.089g·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )。
A.1mol Na被完全氧化生成Na2O2,失去个NA电子
B.标准状况下,22.4L盐酸含有NA个HCl分子
C.标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA
D.50mL 12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com