
| A、该溶液中水电离的c(OH-)与pH=4的NH4Cl溶液中水电离的c(OH-)相同 |
| B、该溶液1mL稀释至100mL后,pH等于6 |
| C、向该溶液中加入等体积、pH=10的氢氧化钠溶液恰好完全中和 |
| D、该溶液与锌反应,pH逐渐增大 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨是一种易溶、易液化的气体 |
| B、氨的水溶液能使紫色石蕊试液变红色 |
| C、氨气不能用浓硫酸来干燥 |
| D、氨气在一定条件下能跟氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液肯定显碱性 |
| B、该溶液可能显酸性 |
| C、该溶液的pH可能为3或11 |
| D、该溶液的pH不可能为11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[H+]随着温度的升高而降低 |
| B、在35℃时,[H+]>[OH-] |
| C、水的电离程度α(25℃)>α(35℃) |
| D、水的电离是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H-为氧化剂 |
| B、NH3为还原剂 |
| C、H2既是氧化产物又是还原产物 |
| D、属于非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加6.5g |
| B、减少6.5g |
| C、减少5.6g |
| D、增加5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
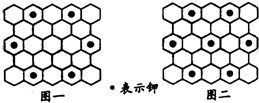 北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的石墨夹层离子化合物.将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等等.在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回.下列分析中正确的是( )
北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的石墨夹层离子化合物.将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等等.在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回.下列分析中正确的是( )| A、题干中所举出的6种钾石墨,属于同素异形体 | ||
| B、若某钾石墨的原于分布如图一所示,则它所表示的是C24K | ||
| C、若某钾石墨的原子分布如图二所示,则它所表示的是C12K | ||
D、另有一种灰色的钾石墨C32K,其中K的分布也类似图中的中心六边形,则最近两个K原子之间的距离为石墨键长的4
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com