
【题目】某烧碱样品含少量不与酸作用的杂质,为测定纯度,进行以下滴定操作:
A.在 250 mL 的容量瓶中定容配成 250 mL 烧碱溶液
B.用移液管移取 25 mL 烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品 Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为 c 的标准盐酸溶液装入酸式滴定管,调节液面,记开始读数为 V1 E.在锥形瓶下垫一张白纸,滴定至终点,记读数 V2
回答下列各问题:
(1)正确操作步骤的顺序是(用字母填写) _______→ ________→ ________→D→ ______。
(2)D 步骤中液面应调节到 ______,尖嘴部分应 ______。
(3)滴定终点时锥形瓶中颜色变化是 ______。
(4)若酸式滴定管不用标准盐酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?______(填“偏高”、“低”或“不变”)
(5)该烧碱样品纯度的计算式为______。
【答案】C A B E 调节到零刻度或零稍下的某一刻度 充满液体,无气泡 溶液由黄色变为橙色 偏高 ![]() %
%
【解析】
(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定;
(2)滴定管0刻度在上;为减小误差,尖嘴部分应充满液体,无气泡;
(3)指示剂为甲基橙,变色范围为3.1-4.4;
(4)因标准液浓度变小,用量变大;
(5)根据反应消耗的盐酸,求出氢氧化钠,进一步求出样品的纯度。
(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,具体步骤为:C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解、A.在250mL容量瓶中定容成250mL烧碱溶液、B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂、D.将物质的量浓度为M mol/L的标准盐酸溶液装入酸式滴定管,调整液面,记下开始刻度为V1mL、E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL,故答案为:C;A;B;E;
(2)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡,故答案为:调节到零刻度或零稍下的某一刻度;充满液体,无气泡;
(3)指示剂为甲基橙,变色范围为3.1-4.4,终点时pH约为4.4;溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色,故答案为:溶液由黄色变为橙色;
(4)若酸式滴定管不用标准盐酸润洗,导致标准液被稀释,则滴定过程中消耗的标准液体积增大,则测定结果偏高,故答案为:偏高;
(5)滴到消耗的盐酸为:n(盐酸)=cV=(V2-V1)×10-3L×cmol/L,根据反应方程可知,n(NaOH)=n(盐酸)=c(V2-V1)×10-3mol,所以原来样品中氢氧化钠的物质的量为:![]() ×c(V2-V1)×10-3mol=c(V2-V1)×10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=40c(V2-V1)×10-2g,则该烧碱样品的纯度为
×c(V2-V1)×10-3mol=c(V2-V1)×10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=40c(V2-V1)×10-2g,则该烧碱样品的纯度为![]() %;故答案为:
%;故答案为:![]() %。
%。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是( )

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液碱性增强
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 阴极区溶液pH降低,阳极区溶液pH升高
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A. Cl2+H2O![]() HCl+HClO,氯水中加入碳酸钙,漂白性增强
HCl+HClO,氯水中加入碳酸钙,漂白性增强
B. ZnS + Cu2+![]() CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
C. 2NO2![]() N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
D. Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石棉尾矿主要含有Mg3(Si2O5)(OH)和少量的Fe2O3、Al2O3。以石棉尾矿为镁源制备碳酸镁晶体(MgCO3·nH2O)的工艺如图:

已知“焙烧”过程中的主反应为:Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
(1)写出焙烧产物NH3的电子式__。
(2)为提高水浸速率,可采取的措施为__(任写一条即可),“浸渣”的主要成分为___。
(3)①“调节pH除杂”时,除去的杂质离子是__,室温下,若要将溶液中的c(Fe3+)降低至4.0×10-11mol/L,则应控制溶液的pH=___(Ksp[Fe(OH)3]=4.0×10-38)。
②“调节pH除杂”时,可以选用的试剂是___。
A.MgO B.NaOH C.MgCO3 D.HNO3
(4)“沉镁”过程中反应的离子方程式为___。“沉镁”时若温度超过60℃,将产生较多的碱式碳酸镁[Mg2(OH)2CO3]杂质,原因是__。
(5)某小组同学称取15.6gMgCO3·nH2O进行热重分析,并绘制剩余固体质量随温度变化的曲线如图所示,则n=__。
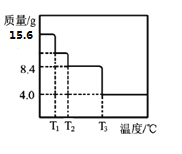
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100mol/LHCl溶液滴定0.100mol/LNa2CO3溶液的滴定曲线如图,已知f=![]() 。下列说法错误的是
。下列说法错误的是
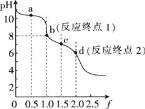
A.a点溶液中:c(HCO3-)>c(CO32-)
B.b点溶液中:c(Na+)>c(HCO3-)+c(CO32-)+c(H2CO3)
C.c点溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D.溶液中水的电离程度:a>b>c>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高电子层符号为__,该电子层具有的原子轨道数为__。
②LiBH4由Li+和BH4-构成,BH4-的立体构型是__,B原子的杂化轨道类型是___。
③Li、B元素的电负性由小到大的顺序为___。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+__H-(填“>”“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是__族元素。
(3)图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和涂“![]() ”分别标明B与N的相对位置___。
”分别标明B与N的相对位置___。
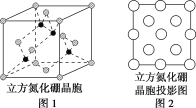
(4)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为__,NaH的理论密度是__g·cm-3(保留3个有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
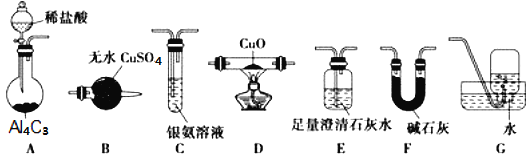
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物,某化学小组利用如图装置探究其反应产物。
查阅资料:
①CO能与银氨溶液反应:CO+2Ag(NH3)2++2OH-=2Ag↓+2NH4++CO32-+2NH3
②Cu2O为红色,不与Ag反应,发生反应:Cu2O+2H+=Cu2++Cu+H2O
③已知Al4C3与CaC2类似易水解,CaC2的水解方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑
(1)装置A中反应的化学方程式为___。
(2)装置F的作用为___;装置B的名称为___。
(3)按气流方向各装置从左到右的连接顺序为A→__。(填装置名称对应字母,每个装置限用一次)
(4)实验中若将A中分液漏斗换成![]() (恒压漏斗)更好,其原因是___。
(恒压漏斗)更好,其原因是___。
(5)装置D中可能观察到的现象是___。
(6)当反应结束后,装置D处试管中固体全部变为红色。设计实验证明红色固体中含有Cu2O(简述操作过程及现象):__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,硫酸与 NaOH 溶液相互滴定的滴定曲线如图所示。下列有关叙述不正确的 是( )

A.曲线 a 是用 NaOH 溶液滴定硫酸的滴定曲线
B.曲线 a 和曲线 b 滴定过程中均存在:c(H+)+c(Na+)=c(OH-)+2c(SO42-)
C.用 NaOH 溶液滴定硫酸溶液时可用酚酞作指示剂
D.等体积的硫酸与 NaOH 溶液分别与等质量铝粉反 应生成 H2 的质量比一定为 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.2mol·L-1NaCN溶液中加入0.2mol·L-1的盐酸,溶液pH随所加盐酸体积的变化如图所示(M>7)。下列说法不正确的是

A. 25℃时,K(HCN)≈10-9.4
B. b点时,c(CN-)<c(HCN)
C. c点时,c(Cl-)>c(H+)+c(HCN)
D. a、b、c三点时,水的电离程度:a>b>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com