
【题目】铝是重要的金属材料,铝土矿![]() 主要成分是
主要成分是![]() 和少量的
和少量的![]() 、
、![]() 杂质
杂质![]() 是工业上制取铝的原料.实验室模拟工业上以铝土矿为原料制取
是工业上制取铝的原料.实验室模拟工业上以铝土矿为原料制取![]() 和铵明矾晶体
和铵明矾晶体![]() 的工艺流程如图所示:
的工艺流程如图所示:

请回答下列问题:
![]() 固体a的化学式为______,Ⅲ中反应的离子方程式为______。
固体a的化学式为______,Ⅲ中反应的离子方程式为______。
![]() 由Ⅴ制取铵明矾溶液的化学方程式为______,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、______
由Ⅴ制取铵明矾溶液的化学方程式为______,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、______![]() 填操作名称
填操作名称![]() 。
。
![]() 若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。
若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。
若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的![]() 和
和![]() 的物质的量之比为______。
的物质的量之比为______。
【答案】![]()
![]()
![]() 过滤洗涤
过滤洗涤 ![]() :10
:10
【解析】
铝土矿用盐酸溶解,Al2O3、Fe2O3反应得到AlCl3、FeCl3,SiO2不与盐酸反应,过滤得到固体a为SiO2,滤液中含有AlCl3、FeCl3及剩余的HCl,再加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色沉淀b为氢氧化铁,溶液中含有偏铝酸钠、氯化钠及剩余的NaOH,通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,过滤,滤液c中含有氯化钠、碳酸氢钠,将沉淀加热分解得到氧化铝,用硫酸溶解得到硫酸铝溶液,再通入氨气,得到铵明矾溶液,最后经过蒸发浓缩、冷却结晶、过滤等操作得到铵明矾晶体。
![]() 铝土矿中
铝土矿中![]() 和
和![]() 能溶于盐酸,
能溶于盐酸,![]() 不溶于盐酸,所以固体a的化学式为
不溶于盐酸,所以固体a的化学式为![]() ,
,![]() 溶于烧碱生成
溶于烧碱生成![]() 溶液,在其中通入
溶液,在其中通入![]() 生成
生成![]() 沉淀,
沉淀,
离子方程式为:![]() ;
;
![]() 分解生成
分解生成![]() ,
,![]() 与稀硫酸、氨气反应生成铵明矾溶液:
与稀硫酸、氨气反应生成铵明矾溶液:![]() ,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤;
,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤;
![]() 设制得的
设制得的![]() 和
和![]() 的物质的量都是1mol,则
的物质的量都是1mol,则![]() 共3mol,
共3mol,![]() 共5mol,根据
共5mol,根据![]() 和
和![]() 守恒原理可得,加入
守恒原理可得,加入![]() 和
和![]() 的物质的量之比为
的物质的量之比为![]() :
:![]() :10。
:10。


科目:高中化学 来源: 题型:
【题目】在常温下,下列电解质溶液的有关叙述正确的是
A.在含有 BaSO4 沉淀的溶液中加入 Na2SO4 固体,c(Ba2+)增大
B.同物质的量浓度、同体积的强酸与强碱溶液混合后,溶液的 pH 一定等于 7
C.含 1mol KOH 的溶液与 1mol CO2 完全反应后,溶液中 c(K+)=c(![]() )
)
D.在 CH3COONa 溶液中加入适量 CH3COOH,可使 c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA (气) ![]() bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质A的质量分数增加了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Na2SO3固体在隔绝空气加热条件下的分解产物,设计如下实验流程:
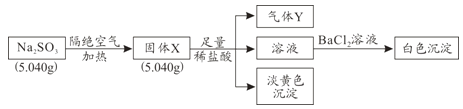
已知:气体Y是一种纯净物,在标准状况下密度为1.518g/L。
请回答下列问题:
(1)气体Y为_______。
(2)固体X与稀盐酸反应产生淡黄色沉淀的离子方程式为_______。
(3)实验过程中若测得白色沉淀的质量为6.291g,则Na2SO3的分解率为_______。
(4)Na2SO3在空气易被氧化,检验Na2SO3是否氧化变质的实验操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后 =11,则溶液中
=11,则溶液中 =
=![]()
B.参加反应的氯气的物质的量等于![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n的范围:![]() a mol ≤ n(e -)≤
a mol ≤ n(e -)≤![]() a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为 ![]() a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H八种短周期主族元素在周期表中的相对位置如图所示,已知C元素形成的单质有“国防金属”的美誉,![]() 的最高化合价与最低化合价之和为2。回答下列问题:
的最高化合价与最低化合价之和为2。回答下列问题:
A | …… | D | E | F | ||
B | C | …… | G | H |
(1)D元素在周期表中的位置为________________。
(2)上述元素所形成的气态单质中能用于饮用水消毒的有________________(填化学式)。
(3)B的单质在F的单质中燃烧的火焰颜色为________。
(4)C元素的单质可以在D和F形成的一种气态化合物中燃烧,写出该反应的化学方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100 mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是 ( )
A. 100 mL的盐酸中HCl的物质的量浓度为7.5 mol·L-1
B. 生成的H2S气体在标准状况下的体积为2.24 L
C. 该磁黄铁矿FexS中,x=0.85
D. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石经处理后得到明矾( KAl(SO4)2·12H2O)。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
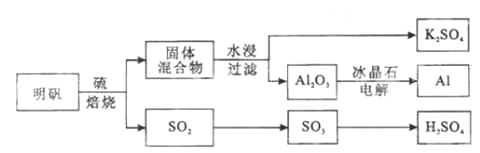
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是__________________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是_____________________。
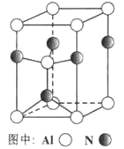
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是____。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是_____________________________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g)![]() 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是__________________________。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是
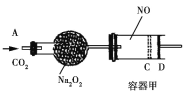
A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com