
【题目】A~H八种短周期主族元素在周期表中的相对位置如图所示,已知C元素形成的单质有“国防金属”的美誉,![]() 的最高化合价与最低化合价之和为2。回答下列问题:
的最高化合价与最低化合价之和为2。回答下列问题:
A | …… | D | E | F | ||
B | C | …… | G | H |
(1)D元素在周期表中的位置为________________。
(2)上述元素所形成的气态单质中能用于饮用水消毒的有________________(填化学式)。
(3)B的单质在F的单质中燃烧的火焰颜色为________。
(4)C元素的单质可以在D和F形成的一种气态化合物中燃烧,写出该反应的化学方程式_____
科目:高中化学 来源: 题型:
【题目】将1 mol甲烷与一定量的氯气混合于一量筒中,倒立于盛有饱和食盐水的水槽(如图所示),对于此反应,有关叙述不正确的是( )
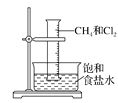
A. 该反应属于取代反应
B. 该反应的条件是光照
C. 该反应的生成物只有四种
D. 该反应现象有量筒内气体颜色变浅,器壁上有油状液滴
查看答案和解析>>
科目:高中化学 来源: 题型:
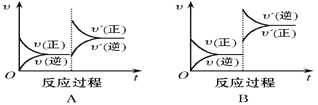
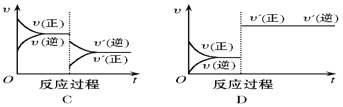
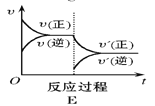
【题目】在一定条件下,反应A(g)+B(g) C(g),H < 0,达到平衡后,根据下列图像判断:
(1)升温,达到新的平衡的是(___________);
(2)降压,达到新的平衡的是(______________);
(3)减少C的量,移向新平衡的是(_____________) ;
(4)增加A的量,移向新平衡的是(____________),此时B的转化率___________(填“增大”或“减小”或“不变”,下空同);
(5)使用催化剂,达到平衡的是(_______________),C的质量分数_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种国际公认的安全、无毒的绿色消毒剂,沸点11℃,凝固点-59℃。工业上,可用下列原理制备ClO2(液相反应):![]() 。设NA是阿伏伽德罗常数的值。下列说法正确的是( )
。设NA是阿伏伽德罗常数的值。下列说法正确的是( )
A.在标准状况下,2240mL ClO2含有原子数为0.3NA
B.若生成1.5mol Na2SO4,则反应后的溶液中Fe3+数目为0.2NA
C.48.0g FeS2完全反应,则上述反应中转移电子数为6NA
D.每消耗30mol NaClO3,生成的水中氢氧键数目为14NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿![]() 主要成分是
主要成分是![]() 和少量的
和少量的![]() 、
、![]() 杂质
杂质![]() 是工业上制取铝的原料.实验室模拟工业上以铝土矿为原料制取
是工业上制取铝的原料.实验室模拟工业上以铝土矿为原料制取![]() 和铵明矾晶体
和铵明矾晶体![]() 的工艺流程如图所示:
的工艺流程如图所示:

请回答下列问题:
![]() 固体a的化学式为______,Ⅲ中反应的离子方程式为______。
固体a的化学式为______,Ⅲ中反应的离子方程式为______。
![]() 由Ⅴ制取铵明矾溶液的化学方程式为______,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、______
由Ⅴ制取铵明矾溶液的化学方程式为______,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、______![]() 填操作名称
填操作名称![]() 。
。
![]() 若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。
若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。
若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的![]() 和
和![]() 的物质的量之比为______。
的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液![]() 含有
含有![]() 、
、![]() 、
、![]() 、
、![]() 等
等![]() 中回收碘,操作过程如下:
中回收碘,操作过程如下:

![]() 向废液中加入
向废液中加入![]() 溶液,发生“还原”反应的离子方程式为 ______。
溶液,发生“还原”反应的离子方程式为 ______。
![]() “氧化”操作在三颈烧瓶中进行,将溶液用盐酸调至pH约为2,缓慢通入
“氧化”操作在三颈烧瓶中进行,将溶液用盐酸调至pH约为2,缓慢通入![]() 。实验用水浴控制在
。实验用水浴控制在![]() 左右的较低温度下进行的原因是 ______。
左右的较低温度下进行的原因是 ______。

![]() 某研究小组用图装置对
某研究小组用图装置对![]() 与KI溶液的反应进行探究,发现通入
与KI溶液的反应进行探究,发现通入![]() 一段时间后,KI溶液变为黄色,继续通入
一段时间后,KI溶液变为黄色,继续通入![]() ,则溶液黄色变浅,最后变为无色.研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
,则溶液黄色变浅,最后变为无色.研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:

假设一:没有![]() 形态;假设二:没有
形态;假设二:没有![]() 形态;假设三:有
形态;假设三:有![]() 形态。
形态。
![]() 请设计实验证明假设一成立
请设计实验证明假设一成立![]() 试剂自选
试剂自选![]() 。
。
实验操作 | 预期现象 | 结论 |
_______ | _______ | 假设一成立 |
![]() 若假设三成立,请写出生成
若假设三成立,请写出生成![]() 的离子方程式 ______。
的离子方程式 ______。
![]() 该研究小组还进行了对加碘盐中
该研究小组还进行了对加碘盐中![]() 含量测定的如下实验:
含量测定的如下实验:
![]() 准确称取加碘盐mg于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成
准确称取加碘盐mg于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成![]() 待测溶液.移取
待测溶液.移取![]() 待测溶液于锥形瓶中,加几滴淀粉试液,用c
待测溶液于锥形瓶中,加几滴淀粉试液,用c![]()
![]() 标准液滴定至终点,重复3次,测得平均值为VmL。
标准液滴定至终点,重复3次,测得平均值为VmL。
已知:![]() ,
,![]() 。测定时,判断达到滴定终点的现象为 ______ ,由测定数据可求得该样品中含
。测定时,判断达到滴定终点的现象为 ______ ,由测定数据可求得该样品中含![]() 的质量分数为 ______
的质量分数为 ______ ![]() 用含m、c、V的代数式表示,
用含m、c、V的代数式表示,![]()
![]() 。
。
![]() 在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因 ______。
在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究光盘金属层含有的Ag(其它金属微量忽略不计)、丢弃电池中的Ag2O等废旧资源的回收利用意义重大。下图为从光盘中提取Ag的工业流程。请回答下列问题。

(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________。有人提出以HNO3代替NaClO氧化Ag,从反应产物的角度分析,其缺点是________。
(3)操作Ⅰ的名称为____,简述利用“操作Ⅰ”的装置洗涤难溶物的实验操作________。
(4)化学上常用10%的氨水溶解AgCl固体,AgCl与NH3·H2O按1︰2反应可生成Cl-和一种阳离子________的溶液(填阳离子的化学式)。实际反应中,即使氨水过量也不能将AgCl固体全部溶解,可能的原因是________。
(5)常温时N2H4·H2O(水合肼)在碱性条件下能还原(4)中生成的阳离子,自身转化为无害气体N2,理论上消耗0.1 mol的水合肼可提取到________g的单质Ag。
(6)废旧电池中Ag2O能将有毒气体甲醛(HCHO)氧化成CO2,科学家据此原理将上述过程设计为原电池回收电极材料Ag并有效去除毒气甲醛。则此电池的正极反应式为________,负极的产物有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种微粒,其中
六种微粒,其中![]() 的物质的量随时间变化的曲线如图所示。下列判断正确的是
的物质的量随时间变化的曲线如图所示。下列判断正确的是
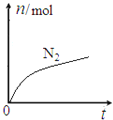
A. 该反应的氧化剂ClO-,还原产物是![]() B. 消耗1mol还原剂,转移6mol电子
B. 消耗1mol还原剂,转移6mol电子
C. 水是生成物,且反应后溶液的酸性明显增强 D. 氧化剂与还原剂的物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
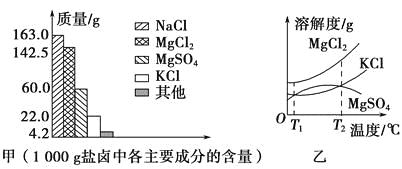
【题目】我国拥有很长的海岸线,具有丰富的海洋资源,以海水为原料的盐化工是我国重要的产业。盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如下图甲)。盐卤在食品、化工等方面具有广泛的用途。请解答下列与盐卤有关的试题。
(1)根据图甲,写出盐卤中含量最多的两种盐的化学式:_______、_______。
(2)下图乙是盐卤中某些物质的溶解度曲线,已知T1℃时,MgSO4和KCl的溶解度分别为M、N,则它们溶解度大小的关系为_______;将盐卤加热到T2℃以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是______________________________________________________。
(3)化工厂利用卤水生产金属镁的工艺流程如下:
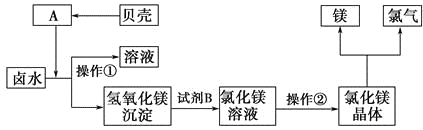
“操作①”的目的是将氢氧化镁沉淀分离出来,操作①的名称是_______。氢氧化镁与试剂B反应的化学方程式为______________________________。
操作②的名称是_______。该方法的优点为___________________________。
(4)用电解法制备金属镁,两位同学分别设计了下面的两种方法。
甲:电解氯化镁溶液。
乙:电解熔融的氯化镁。
其中同学_______(填“甲”或“乙”)能够成功地制备金属镁,假设生产过程中镁元素没有损失,则100 g卤水可制备镁_______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com