
【题目】钛被誉为“21世纪的金属”,可呈现多种化合价.其中以+4价的Ti最为稳定.回答下列问题:
(1)基态Ti原子的价电子轨道表示式为________.
(2)已知电离能:I2(Ti)=1310kJ/mol,I2(K)=3051kJ/mol.I2(Ti)<I2(K),其原因为________.
(3)钛某配合物可用于催化环烯烃聚合,其结如下图所示:

①铁的配位数为________,碳原子的杂化类型________.
②该配合物中存在的化学键有________(填字母标号).
a.离子健 b.配位键 c.金属健 d.共价键 e.氢键
(4)钛与卤素形成的化合物熔沸点如下表所示:

分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是________.
(5)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为____.阴离子的空间构型为____.

(6)已知TiN晶体的晶胞结构如下图所示,若该晶胞的密度ρg/cm3,阿伏加德罗常数值为NA则晶胞中Ti原子与N原子的最近距离为________pm.(用含ρ、NA的代数式表示)

【答案】![]() K+失去的是全充满的3p6电子,Ti+失去的是4s1电子,相对较易失去,故I2(Ti)<I2(K) 6 sp3,sp2 bd 三者均为分子晶体,组成与结构相似,随着相对分子质量增大,分子间作用力增大,熔沸点升高 TiO2+ 正四面体
K+失去的是全充满的3p6电子,Ti+失去的是4s1电子,相对较易失去,故I2(Ti)<I2(K) 6 sp3,sp2 bd 三者均为分子晶体,组成与结构相似,随着相对分子质量增大,分子间作用力增大,熔沸点升高 TiO2+ 正四面体 ![]()
【解析】
第(1)问从基态微粒的电子排布式分析,第(2)问依据价层电子排布特点从电离能角度分析,第(3)(5)问从原子的杂化方式、分子空间构型角度分析,第(4)问判断出晶体类型后从分子量角度比较熔沸点即可,第(6)问从晶胞为单位的密度计算突破。
(1)基态Ti原子的质子数为22,Ti原子价电子为3d、4s电子,3d能级上有2个电子、4s能级上有2个电子,则其价电子轨道表示式为![]() ;
;
(2)I2表示得失第二电离能。K+失去的是全充满的3p6电子,Ti+失去的是4s1电子,相对较易失去,故I2(Ti)<I2(K);
(3)①由图知钛的配位数为6,甲基上碳原子为四面体构型,杂化类型为sp3,环上碳碳双键为平面型,碳原子为sp2杂化;②钛与周围原子形成配位键,而其余非金属元素间为共价键,本题答案:bd;
(4)TiCl4、TiBr4、TiI4三者均为分子晶体,组成与结构相似,随着相对分子质量增大,分子间作用力增大,熔沸点升高;
(5)每个O原子被两个Ti原子共用、每个Ti原子被两个O原子共用,利用均摊法计算二者原子个数之比为1:1;Ti元素为+4价、O元素为-2价,据此书写其化学式为TiO2+;阴离子为硫酸根,其价层电子对数=4+(6-4×2+2)/2=4,为正四面体构型;
(6)由均摊法可计算出一个晶胞中有4个TiN,设晶胞中Ti原子与N原子的最近距离为x pm,则![]() ,TiN的摩尔质量为62g/mol,解出x=
,TiN的摩尔质量为62g/mol,解出x=![]() pm。
pm。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关性质的比较中,不正确的是
A. 硬度由大到小:金刚石>碳化硅>晶体硅
B. 晶格能:NaBr<NaCl<MgO
C. 键的极性:N-H<O-H<F-H
D. 熔点:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国的丹尼尔·诺切拉博士公布了自己团队研发的“人造树叶”,它可以与燃料电池共同构成一个新的发电装置——太阳能燃料电池,工作原理如图所示,下列有关叙述正确的是


A.太阳能燃料电池的优点为无论天气如何,均能持续供应电能,并且实现对环境的“零排放”
B.图A中塑料薄膜上部的反应为2H++2e-![]() H2↑
H2↑
C.图B燃料电池工作时的负极反应物为O2
D.“人造树叶”上发生的反应为6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就转移、定容,所配制的溶液浓度偏大
B. 用广泛pH试纸测得氯水的pH为3
C. 用托盘天平称取5.86g食盐
D. 用细铁丝放在酒精灯火焰上灼烧至无色,然后蘸取少量待测液,透过蓝色钴玻璃观察火焰呈紫色,说明待测液中一定含有K+,没有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. NH4Cl晶体中只含离子键
B. CH4、SiH4、GeH4分子间作用力依次增大
C. 金刚石是原子晶体,加热融化时需克服分子间作用力与共价键
D. NH3和CO2两种分子中,每个原子的最外层都具有8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:X(g)+2Y(g)![]() 3Z(g) △H=-akJ·mol-1(a>0)。下列说法正确的是
3Z(g) △H=-akJ·mol-1(a>0)。下列说法正确的是
A. 达到平衡状态时,放出的热量一定小于a kJ
B. 向体系中加入X(g)时,正、逆反应速率一定都增大
C. 当容器内的压强保持不变时,则反应一定达到平衡状态
D. 若Y与Z的物质的量之比保持不变,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V L Fe2(SO4)3溶液中含有ag SO42-,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量浓度为( )
A.![]() mol·L-1B.
mol·L-1B.![]() mol·L-1C.
mol·L-1C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,反应4Fe(OH)2(s)+ 2 H2O(l)+ O2(g)═ 4 Fe(OH)3(s)能自发进行,则△ H<0
B. 有气体参与的可逆反应,在一定条件下达到平衡时,改变压强平衡一定发生移动
C. 化学平衡常数只与温度有关,与化学计量数无关
D. t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)NO(g)+SO3(g),通入少量O2,![]() 的值及SO2转化率不变
的值及SO2转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
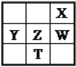
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com