
【题目】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应生成硼酸(H3BO3)的化学方程式_____________。为提高浸出速率,除适当增加硫酸的浓度外,还可采取的措施有_________(写出两条)。
(2)利用_______的磁性,可将其从“矿粉”中分离。“浸渣”中的物质是______(写化学式)。
(3) “净化除杂”需先加H2O2溶液,作用是(用离子方程式表示)_______。然后再调节溶液的pH约为5,目的是________。
(4)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_______。
【答案】 Mg2B2O5·H2O+2H2SO4![]() 2MgSO4+2H3BO3 减小铁硼矿粉粒径、提高反应温度、搅拌或其它合理答案 Fe3O4 SiO2和CaSO4 2Fe2++H2O2+2H+=Fe3+ + 2H2O 使Al3+与Fe3+形成氢氧化物而除去
2MgSO4+2H3BO3 减小铁硼矿粉粒径、提高反应温度、搅拌或其它合理答案 Fe3O4 SiO2和CaSO4 2Fe2++H2O2+2H+=Fe3+ + 2H2O 使Al3+与Fe3+形成氢氧化物而除去 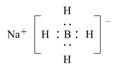
【解析】Fe3O4具有磁性,可将Fe3O4从“矿粉”中分离。“硫酸浸出”过程中,Mg2B2O5·H2O、Fe3O4、Fe2O3、FeO、CaO、Al2O3与硫酸反应生成MgSO4、H3BO3、Fe2(SO4)3、FeSO4、CaSO4、Al2(SO4)3,SiO2难溶于硫酸,过滤后的浸渣为SiO2和微溶于水的CaSO4;“净化除杂”加入H2O2将Fe2+氧化成Fe3+,然后调节pH约为5,根据流程,Fe3+、Al3+依次转化为Fe(OH)3、Al(OH)3沉淀而除去;滤液经蒸发浓缩、冷却结晶、过滤得到粗硼酸。
Fe3O4具有磁性,可将Fe3O4从“矿粉”中分离。“硫酸浸出”过程中,Mg2B2O5·H2O、Fe3O4、Fe2O3、FeO、CaO、Al2O3与硫酸反应生成MgSO4、H3BO3、Fe2(SO4)3、FeSO4、CaSO4、Al2(SO4)3,SiO2难溶于硫酸,过滤后的浸渣为SiO2和微溶于水的CaSO4;“净化除杂”加入H2O2将Fe2+氧化成Fe3+,然后调节pH约为5,根据流程,Fe3+、Al3+依次转化为Fe(OH)3、Al(OH)3沉淀而除去;滤液经蒸发浓缩、冷却结晶、过滤得到粗硼酸。
(1)Mg2B2O5·H2O与硫酸反应生成H3BO3、MgSO4,反应的化学方程式为Mg2B2O5·H2O+2H2SO4![]() 2MgSO4+2H3BO3。根据外界条件对化学反应速率的影响,为提高浸出速率,除适当增加硫酸的浓度外,还可采取的措施有:减小铁硼矿粉的粒径、提高反应温度、搅拌等。
2MgSO4+2H3BO3。根据外界条件对化学反应速率的影响,为提高浸出速率,除适当增加硫酸的浓度外,还可采取的措施有:减小铁硼矿粉的粒径、提高反应温度、搅拌等。
(2)利用Fe3O4的磁性,可将其从“矿粉”中分离。根据上述分析,SiO2难溶于硫酸,CaO与硫酸反应生成微溶于水的CaSO4,“浸渣”中的物质是SiO2和CaSO4。
(3)“硫酸浸出”过程中生成了FeSO4,“净化除杂”时加入H2O2溶液将Fe2+氧化成Fe3+,反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O。根据流程,调节溶液的pH约为5,目的是使Fe3+、Al3+依次转化为Fe(OH)3、Al(OH)3沉淀而除去。
(4)NaBH4中Na+与BH4-间为离子键,BH4-内B原子与H原子间为共价键,NaBH4的电子式为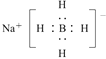 。
。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】氢气和氟气反应生成氟化氢的过程中能量变化如图所示。由图可知

A. 生成1 molHF气体放出的热量为270 kJ
B. H2(g)+ F2(g)→ 2HF(l)+ 270 kJ
C. 反应物的总能量大于生成物的总能量
D. 该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小刚同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验。
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为
________________________________________________________________________,
过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为
________________________________________________________________________。
(2)请回答有关问题。小刚同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明
显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:
![]()
![]()
![]()
![]()
![]()
则操作①的名称为________,试剂A的化学式为________。
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是________(填化学式),产生该白色沉淀的离子方程式是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g)CO(g)+H2(g) 。下列条件的改变对反应速率几乎没有影响的是( )
A. 增加C的量;
B. 减少CO的量;
C. 升高反应体系的温度;
D. 保持压强不变,充入He以增大体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y的核电荷数分别是a和b,它们的离子Xn+和Ym-的核外电子排布相同,则下列关系式中正确的是( )
A. a=b+m+n B. a=b-m+n
C. a=b+m-n D. a=b-m-n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分
族 周期 | |||||||
① | |||||||
Li | C | ④ | ⑤ | ⑥ | |||
⑦ | ⑧ | ⑨ | ⑩ | ||||
K | ⑾ | ||||||
(1)表中元素______的非金属性最强(填写元素符号,下同);元素______的单质室温下呈液态,它的原子序数是__________
(2)表中元素⑤和⑦、①和⑤均可以组成原子比例为1:1的物质,这两种物质内所含有的相同的化学键是________键(填写“离子键”、“极性共价键”或“非极性共价键”);表中元素⑥⑩⑾氢化物的稳定性由大到小的顺序为:____________________(填写化学式,下同;
(3)表中有一种元素的单质可作为半导体材料,它在元素周期表中的位置是____________;用电子式表示表中⑧⑩两元素形成化合物的过程____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)B为__________(填写元素符号),D的最高价氧化物对应的水化物是_________(填写化学式),离子半径大小B_________C(填“>”“<”或“=”);
(2)写出A、B的化合物与E反应的化学方程式:______________________;A、B两元素形成的化合物属于_________(填“离子”或“共价”)化合物。
(3)A的单质与D的最高价氧化物对应的水化物反应的化学方程式为_______________。
Ⅱ.常温下由三种短周期元素形成的气体单质X、Y、Z,有下列转化关系(反应条件已略去):

已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(4)化合物甲的电子式是_____________;化合物丙中存在的化学键为___________、_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中发生如下可逆反应:2X(g)+Y(s)![]() 3Z(g) ΔH= QkJ/mol,下列说法正确的是
3Z(g) ΔH= QkJ/mol,下列说法正确的是
A. 消耗2 mol X同时生成3 mol Z,说明达到了平衡状态
B. 加入少量的Y正反应速率加快
C. 气体的密度不变时,说明达到了平衡状态
D. 加入少量的X,Q变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的.周期数与主族序数相等。
![]()
请回答下列问题:
(1)W在周期表中的位置是____________________________________,Q、R、T三种元素原子半径由大到小的顺序为____________________________________________________________________。(用元素符号表示),QO2的电子式为________________________,R的最高价氧化物的化学式____________________________。
(2)T单质与NaOH 溶液反应的离子方程式为____________________________________________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com