
【题目】2018年大部分地区爆发了流感流感常伴随发热高烧等症状。布洛芬是一种常用的儿童退热药,它的BHC合成法如下
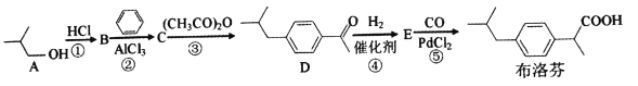
(1)A的名称是__________,B的核磁共振氢谱有__________种吸收峰。
(2)①反应需用浓盐酸而不用稀盐酸,其原因是______________________________。
(3)E的分子式是__________,官能团的名称是__________。
(4)③反应的化学方程式是____________________,反应类型是__________。
(5)满足下列条件的布洛芬的同分异构体有__________种
a遇FeCl3溶液显紫色 b.分子中有5种不同化学环境的氢 c.能发生银镜反应
(6)请写出由苯和( CH3COOCH2CO)2O为原料合成![]() 的线路图(其他试剂任选)___________
的线路图(其他试剂任选)___________
【答案】 2-甲基-1-丙醇 3 增大反应物浓度,加快反应,使平衡右移提高醇利用率(或转化率) C12H18O 羟基 ![]() +(CH3CO)2O
+(CH3CO)2O![]()
![]() + CH3COOH 取代反应 4
+ CH3COOH 取代反应 4 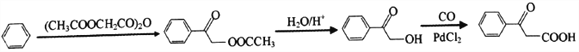
【解析】(1)A的名称是2-甲基-1-丙醇,A与浓盐酸发生取代反应,生成(CH3)2CHCH2Cl,共有三种等效氢,所以核磁共振氢谱有3种吸收峰;
(2)使用浓盐酸可以增大反应物浓度,加快反应,使平衡右移提高醇利用率(转化率);
(3)D与氢气发生是D中的羰基上的碳氧双键与氢气发生加成反应,生成对应的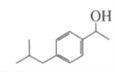 ,确定分子式为C12H18O,官能团为羟基;
,确定分子式为C12H18O,官能团为羟基;
(4)反应③是乙酸的酸酐和苯上的氢发生了取代反应,反应方程式为:![]() +(CH3CO)2O
+(CH3CO)2O![]()
![]() + CH3COOH,该反应类型是取代反应;
+ CH3COOH,该反应类型是取代反应;
(5)遇FeCl3溶液显紫色说明有酚羟基,能发生银镜反应说明有醛基,同时有5种不同环境的氢,可以判断出可能有结构有以下几种: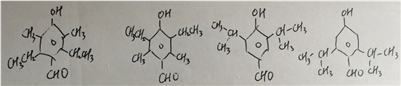 ,一共有4种符合条件的同分异构体。
,一共有4种符合条件的同分异构体。
(6)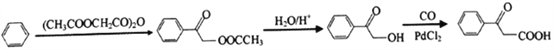


科目:高中化学 来源: 题型:
【题目】某厂排出的废液主要含有硝酸锌和硝酸银,为了从中回收金属银和硝酸锌,某中学化学课外活动小组设计了以下的实验步骤:

(1)X是____________,Y是____________ (写化学式,下同)。
(2)固体A、滤液B、C的主要成分:A______________,B______________,C______________。
(3)Z处进行的操作是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A元素的单质为A2,不能形成A3或A4,这体现了共价键的___性;B元素单质的一种空间网状结构的晶体熔点>3550℃,该单质的晶体类型属于________;基态D原子共有___种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是___________,该分子与D2+、H2O以2:1:2的配比结合形成的配离子是_________(填化学式),此配离子中的两种配体的不同之处为_____(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数 ③中心原子的化学键类型 ④VSEPR模型
(3)1molBC—中含有的π键数目为______;写出与BC-互为等电子体的分子和离子各一种______、______。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原因是______。
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3—半径分别为apm、bpm,D+和C3—都是紧密接触的刚性小球,则C3—的配位数为_____,晶体的密度为____g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第34号元素,是人体内不可或缺的微量元素,可以形成H2Se、SeO2、H2SeO3、H2SeO4、CuSe等多种化合物。请回答下列问题:
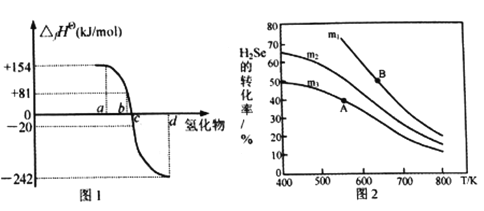
(1)硒在元素周期表中的位置________________________。
(2)在101kPa、一定温度(一般是298K)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的标准生成热(△fHθ)。图1为氧族元素氢化物a、b、c、d呈气态时的生成热数据。
①图1中氢化物d的电子式为__________________________。
②在298K时,硒化氢分解反应的热化学反应方程式为__________________________。
③由图中数据计算,2H2Se(g)+O2(g) ![]() 2Se(s)+2H2O(g) △H=_____________KJ/mol
2Se(s)+2H2O(g) △H=_____________KJ/mol
(3)在恒容反应器中,将H2Se(g)和O2(g)按不同比例[n(H2Se)/n(O2)=m]投入反应器,测得反应2H2Se(g)+O2(g) ![]() 2Se(s)+2H2O(g)中H2Se的平衡转化率随温度变化如图2所示。则A、B两点平衡常数大小关系为KA________KB(填“<”、“>”或“=”),图中m1、m2、m3由大到小的顺序为 ____________,理由是____________________________________。
2Se(s)+2H2O(g)中H2Se的平衡转化率随温度变化如图2所示。则A、B两点平衡常数大小关系为KA________KB(填“<”、“>”或“=”),图中m1、m2、m3由大到小的顺序为 ____________,理由是____________________________________。
(4)常温下溶度积:Ksp(CuSe)=7.9x10-49,Ksp(CuS)=1.3×10-36。则反应CuS(s)+Se2-(aq) ![]() CuSe(s)+S2-(aq)的化学平衡常数K为____________(结果用科学记数法表示,并保留2位小数)。当溶液中c(S2-)=100c(Se2-)时,反应中v(正)_____v(逆)(填“<”、“>”或“=”) 。
CuSe(s)+S2-(aq)的化学平衡常数K为____________(结果用科学记数法表示,并保留2位小数)。当溶液中c(S2-)=100c(Se2-)时,反应中v(正)_____v(逆)(填“<”、“>”或“=”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有氯化铁溶液的烧杯中加入过量的铜粉,反应结束后,溶液中大量存在的金属离子是( )
A.Fe2+、Fe3+
B.Fe2+、Cu2+
C.Fe3+、Cu2+
D.Cu+、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 mol·L-1;![]() H2SO4(浓)+NaOH(aq)===
H2SO4(浓)+NaOH(aq)===![]() Na2SO4(aq)+H2O(l) ΔH2=m,下列说法不正确的是
Na2SO4(aq)+H2O(l) ΔH2=m,下列说法不正确的是
A. 上述热化学方程式中的计量数表示分子数。
B. ΔH1>ΔH2
C. ΔH2应为![]() H2SO4(浓)溶于水的能量变化与中和热之和。
H2SO4(浓)溶于水的能量变化与中和热之和。
D. |ΔH1|〈|ΔH2|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,X表示某物,Y表示X物质中含有的少量杂,Z表示要除去杂质加入的试剂,其中正确的组别是( )
X | Y | Z | |
A | FeCl2 溶液 | FeCl3 | KSCN 溶液 |
B | H2 | SO2 | NaOH 溶液 |
C | Fe2(SO4)3溶液 | FeSO4 | Cl2 |
D | SiO2 | Fe2O3 | NaOH 溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为短周期元素,原子序数依次增大。25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1)的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:b>a
B. d元素氧化物的水化物一定是强酸
C. 气态氢化物的稳定性:d>c
D. b、c的简单离子都能破坏水的电离平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com