
【题目】常温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生反应N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a值为________。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中氨气体积分数为25%,平衡时氨气的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n始∶n平=________。
(4)原气体中a∶b=________。
(5)达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=________。
(6)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
【答案】16 8 mol 5∶4 2∶3 1∶2 3∶3∶2
【解析】
(1)根据三段式计算;
(2)计算出混合气体总的物质的量,利用体积分数计算氨气的物质的量;
(3)利用差量法计算原混合气体的物质的量;
(4)原混合气体的物质的量减去氮气的物质的量为氢气的物质的量,据此计算;
(5)根据差量法计算出反应消耗的氮气和氢气的物质的量,计算出转化率;
(6)根据①②中数据计算出达到平衡时,反应混合物各组分的物质的量,据此计算。
(1)设反应转化的N2的物质的量为x,由题意可知:
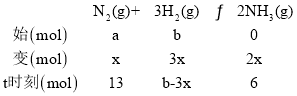
由2x=6得x=3,a=13+3=16;
(2)反应达平衡时,混合气体为![]() =32mol,其中NH3的物质的量为32mol×25%=8mol;
=32mol,其中NH3的物质的量为32mol×25%=8mol;
(3)设反应过程中混合气体总物质的量减少y,则
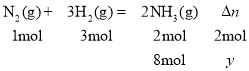
解得y=8 mol,原混合气体总物质的量为![]() +8 mol=40 mol,则n始∶n平=40 mol∶32 mol=5∶4;
+8 mol=40 mol,则n始∶n平=40 mol∶32 mol=5∶4;
(4)由(1)知a=16mol,则b=40mol16mol=24mol,所以:a∶b=16 mol∶24 mol=2∶3;
(5)平衡时,氮气的转化率为![]() ×100%=25%,氢气的转化率为
×100%=25%,氢气的转化率为![]() ×100%=50%,达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=1∶2。
×100%=50%,达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=1∶2。
(6)反应过程中各物质的物质的量如下:
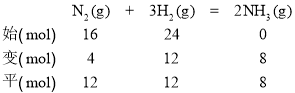
平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=12 mol∶12 mol∶8 mol=3∶3∶2。


科目:高中化学 来源: 题型:
【题目】18.4 g 氢氧化钠和碳酸氢钠固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6 g。试计算原混合物中碳酸氢钠的质量分数。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是氢氧燃料电池的示意图,按图中提示,下列叙述不正确的是( )

A. a电极是负极,b电极是正极
B. a电极的电极反应式为H2-2e-===2H+
C. b电极的电极反应式为4OH--4e-===2H2O+O2↑
D. 氢氧燃料电池不需要将还原剂和氧化剂全部储藏在电池内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100molL-1的NH4SCN溶液滴定25.00mL0.100molL-1AgNO3溶液,以NH4Fe(SO4)212H2O为指示剂,测得溶液中pSCN=lgc(SCN-)、pAg=lgc(Ag+)随加入NH4SCN溶液的体积变化如图所示。已知:Ag++SCN-AgSCN↓,Ksp(Ag2SO4)=1.4×10-5。下列说法错误的是( )

A.滴定至终点时溶液颜色变为红色,且振荡后不褪色
B.该温度下AgSCN的溶度积常数Ksp=1.0×10-12
C.为防止指示剂失效,溶液应维持酸性
D.当加入15.00mLNH4SCN溶液时,溶液中c(SO42-)=0.14molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月15日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(SARS-CoV-2)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
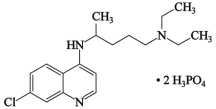
(1)C、N、O三种元素第一电离能从大到小的顺序为_____________;电负性χ(P)_____χ(Cl)(填“>”或“<”);
(2)磷酸氯喹中N原子的杂化方式为_____,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是___________;
(3)磷化镓与砷化镓是两种由ⅢA族元素与ⅤA族元素人工合成的Ⅲ-Ⅴ族化合物半导体材料。其晶胞结构可看作金刚石晶胞内部的碳原子被P(As)原子代替,顶点和面心的碳原子被Ga原子代替。
①基态Ga原子核外电子排布式为__________;
②砷化镓晶体中含有的化学键类型为___________(填选项字母);
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
③磷化镓与砷化镓具有相似的晶体结构,其中熔点较高的是__________(填化学式),原因是_______________;
④以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为__________;若磷化镓的晶体密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为__________ pm(用代数式表示)。
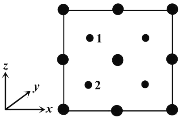
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是制取溴苯的装置。回答下列问题:
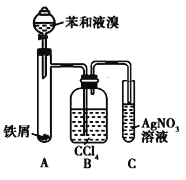
(1)装置C中观察到的现象是_____,证明_____。
(2)装置B是吸收瓶,瓶内盛有CCl4,实验中观察到的现象是_____,原因是_____;
(3)如果没有装置B,将装置A、C直接相连,则该套实验装置 _____(填“合理”或 “不合理”),原因是_____。
(4)实验完毕后,将装置A试管中的液体倒入盛有冷水的烧杯中,烧杯_____(填“下”或“上”)层为溴苯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地奥司明片是治疗静脉淋巴功能不全相关的各种症状(腿部沉重、疼痛、晨起酸胀不适感)的主要治疗药物,下图为合成地奥司明片重要中间体,下列有关说法正确的是( )

A. 分子式为C18H20O6
B. 该中间体是高分子化合物
C. 该中间体可发生水解反应生成乙醇
D. 该中间体分子在一定条件下可以发生取代、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g)![]() r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是
r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是

A. T1>T2,p1>p2,m+n>r,正反应吸热
B. T1<T2,p1<p2,m+n<r,正反应吸热
C. T1>T2,p1>p2,m+n<r,正反应放热
D. T1<T2,p1<p2,m+n>r,正反应放热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com