
【题目】碱金属元素及其单质从Li→Cs的性质递变规律正确的是
A.密度逐渐增大B.熔沸点逐渐升高
C.金属性逐渐增强D.还原性逐渐减弱
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素X、Y、Z、W的原子序数依次增大。化合物甲由X、Y、Z三种元素组成,25℃时,0.01mol/L 甲溶液中的c(OH-)/c(H+)=1010;Z与W 同周期,且W的最高化合价与最低化合价的代数和为4。下列说法中正确的是
A. 等物质的量的化合物Z2Y2 与Z2W的阴离子个数相同
B. 原子半径X
C. 沾有W的单质的试管可用酒精洗涤
D. 简单氢化物的稳定性Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X2+ 和Y- 与氩(18Ar)的电子层结构相同,下列判断中不正确的是
A.原子半径: X>YB.原子序数: X>Y
C.最外层电子数: X>YD.电子层数: X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于元素周期表结构的叙述中,正确的是
A.7个横行代表7个周期,18个纵行代表18个族
B.副族元素中没有非金属元素
C.除第一周期外,其他周期均有18种元素
D.碱金属元素是指ⅠA族的所有元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖表彰了两项成果,其中一项是瑞士科学家库尔特·维特里希“发明了利用核磁共振技术测定溶液中生物大分子三维结构的方法”。在化学上经常使用的是氢核磁共振谱,它是根据不同化学环境的氢原子在氢核磁共振谱中给出的信号不同来确定有机物分子中氢原子种类的。下列有机物分子中,在氢核磁共振谱中信号强度(个数比)是1:3的是
A. 1,2,3-三甲基苯 B. 丙烷
C. 异丙醇 D. 甲酸叔丁酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得。下列有关说法正确的是
A. S2Cl2的电子式为![]()
B. 固态时S2Cl2属于原子晶体
C. S2Cl2与NaOH的化学方程式可能为:S2Cl2+6NaOH=2NaCl+Na2SO3+Na2S+3H2O
D. S2Cl2是含有极性键和非极性键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol/LNaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
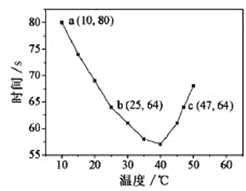
A. 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3反应速率相等
C. 图中a点对应的NaHSO3反应速率为5.0×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.CO2的转化一直是全球研究的热点,其中将CO2和H2合成甲醇及二甲醚 (CH3OCH3)具备相对成熟的技术。工业生产中,有以下相关反应
①CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l) △H < 0
CH3OH(l) + H2O(l) △H < 0
②2 CH3OH(l) ![]() CH3OCH3(g) + H2O(l) △H < 0
CH3OCH3(g) + H2O(l) △H < 0
③CO(g) + H2O(l) ![]() CO2(g) + H2(g) △H < 0
CO2(g) + H2(g) △H < 0
(1)在一常温恒容的密闭容器中,放入一定量的甲醇如②式建立平衡,以下说法正确并可以作为该反应达到平衡状态的判断依据为________。
A.容器内气体相对分子质量保持不变
B.容器内气体压强不变
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍;
D.甲醇和二甲醚物质的量相等
(2)在三个体积相同的密闭容器A,B,C中加入相同物质的量的CO和H2O在不同温度下发生反应③,经过相同时间后测得容器中的CO物质的量与温度的关系如下图:

① A、B两点的速率大小v(A)___v(B)(填“大于”、“小于”、“等于”、“无法判断”)
② 请解释曲线中CO的物质的量先减小后增大的原因________________________。
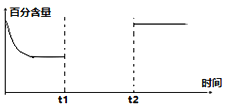
(3)一定量的CO2和H2在一密闭容器中发生反应①,下左图是容器内CO2的百分含量随着外界条件改变的变化曲线图,请补充完整。(t1时刻升温;t2时刻加催化剂)______

Ⅱ.SO2的尾气处理通常用电化学处理法
(4)①如上右图所示,Pt(Ⅱ)电极的反应式为__________________;
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加_____mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸钾(K2S2O8) 在科研与工业上有重要用途。
(1)S2O82-的结构式为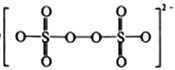 ,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
(2)某厂采用湿法K2S2O8氧化脱硝和氨法脱硫工艺综合处理锅炉烟气,提高了烟气处理效率,处理液还可以用作城市植被绿化的肥料。
①脱硫过程中,当氨吸收液的pH=6时,n(SO32-)∶n(HSO3-) =________。
[巳知:25℃时,Ka1(H2SO3)=1.5×10-2,K a2(H2SO3)=1.0×10-7]
②脱硝过程中依次发生两步反应:第1步,K2S2O8将NO氧化成HNO2,第2步,K2S2O8继续氧化HNO2,第2步反应的化学方程式为______________________________________;
一定条件下,NO去除率随温度变化的关系如右图所示。80℃时,若NO初始浓度为450mg·m-3,t min达到最大去除率,NO去除的平均反应速率:
v(NO) =____mol·L-1·min-1(列代数式)
(3)过二硫酸钾可通过“电解→转化→提纯”方法制得,电解装置示意图如右图所示。
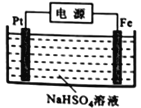
①电解时,铁电极连接电源的_________________极。
②常温下,电解液中含硫微粒的主要存在形式与pH的关系如下图所示。
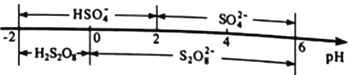
在阳极放电的离子主要是HSO4-,阳极区电解质溶液的pH范围为_________,阳极的电极反应式为________________________。
③往电解产品中加入硫酸钾,使其转化为过二硫酸钾粗产品,提纯粗产品的方法_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com