
【题目】在生产生活中,我们会遇到各种各样的化学反应。请按要求回答下列问题:
(1)焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、N2、Fe2O3、Fe、FeCl3 和 X。
①根据题意,可判断出X是_____________(写化学式)
②写出并配平该反应的化学方程式,并用双线桥标出电子转移的方向和数目:______。
(2)铝元素是自然界中含量最多的的金属元素,应用广泛。金属铝既能与酸反应又能与强碱反应,请写出铝与强碱反应的离子方程式__________________________________________ 。
(3)Na2O2可用作呼吸面具的供氧剂, 发生反应的化学方程式为__________________________。
(4)“水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀的缘故。写出反应的离子方程式_________________________________。
(5)小苏打可作胃药,请写出其中和胃酸时的离子方程式______________________ 。
(6)在反应 3BrF3+5H2O = HBrO3+Br2+9HF+O2 中,被氧化的元素是____________,当有5 mol水反应时,由H2O还原的BrF3为______________mol。
【答案】 H2O 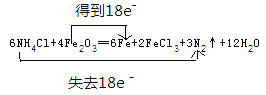 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Na2O2+2CO2=2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑ SiO32-+CO2+H2O=H2SiO3↓+CO32- HCO3-+H+=H2O+CO2↑ O、Br 4/3
2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Na2O2+2CO2=2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑ SiO32-+CO2+H2O=H2SiO3↓+CO32- HCO3-+H+=H2O+CO2↑ O、Br 4/3
【解析】(1)①根据焊药为氯化铵,其作用是消除焊接处的铁锈可知反应物为NH4Cl、Fe2O3,则该反应的生成物为FeCl3、N2、Fe和X,根据原子守恒可知X中含有H、O元素,则X为H2O;②由反应物和生成物可知,NH4Cl+Fe2O3→Fe+FeCl3+N2↑+H2O,该反应Fe元素的化合价由+3价降低为0,N元素的化合价由-3价升高到0,根据电子守恒可知,得电子数=失去电子数=18e-,则6NH4Cl+Fe2O3→6Fe+FeCl3+3N2↑+H2O,再质量守恒定律可知,配平的化学反应为6NH4Cl+4Fe2O3=6Fe+2FeCl3+3N2↑+12H2O,电子转移情况为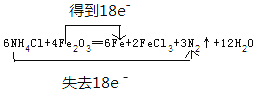 。(2)铝与强碱反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。(3)Na2O2能与水或二氧化碳反应产生氧气,可用作呼吸面具的供氧剂,发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑。(4)“水玻璃”是硅酸钠的水溶液,与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀是硅酸,反应的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-。(5)小苏打是碳酸氢钠,可作胃药,中和胃酸时的离子方程式为HCO3-+H+=H2O+CO2↑。(6)在氧化还原反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,化合价升高的元素是水中的氧元素和BrF3中的溴元素,氧、溴元素被氧化,当有5mol水反应时,化合价升高的元素之一是水中的氧元素从-2价升到0价,被氧化的水的物质的量为2mol,化合价降低的元素是BrF3中的溴元素从+3价降到0价,被还原的物质的量为2mol,其中由H2O还原的BrF3为:2×2/3=4/3mo。
。(2)铝与强碱反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。(3)Na2O2能与水或二氧化碳反应产生氧气,可用作呼吸面具的供氧剂,发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑。(4)“水玻璃”是硅酸钠的水溶液,与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀是硅酸,反应的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-。(5)小苏打是碳酸氢钠,可作胃药,中和胃酸时的离子方程式为HCO3-+H+=H2O+CO2↑。(6)在氧化还原反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,化合价升高的元素是水中的氧元素和BrF3中的溴元素,氧、溴元素被氧化,当有5mol水反应时,化合价升高的元素之一是水中的氧元素从-2价升到0价,被氧化的水的物质的量为2mol,化合价降低的元素是BrF3中的溴元素从+3价降到0价,被还原的物质的量为2mol,其中由H2O还原的BrF3为:2×2/3=4/3mo。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以A和B为原料合成扁桃酸衍生物F的路线如图: 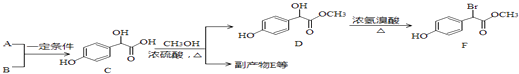
(1)A分子式为C2H2O3 , 可发生银镜反应,且具有酸性,A所含官能团名称为 , 写出A+B→C的化学反应方程式:;
(2)C(  )中①、②、③3个﹣OH的酸性由强到弱的顺序是;
)中①、②、③3个﹣OH的酸性由强到弱的顺序是;
(3)E是由2分子C生成的含有3个六元环的化合物,E分子中不同化学环境的氢原子有种.
(4)D→F的反应类型是 , 1molF在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为mol.写出符合下列条件的F的一种同分异构体(不考虑立体异构)的结构简式: . ①属于一元酸类化合物
②苯环上只有2个取代基且处于对位,其中一个是羟基
(5)已知:R﹣CH2﹣COOH ![]()
![]() .A有多种合成方法,请写出由乙酸合成A的路线流程图(其他原料任选),合成路线流程图示例如下:H2C=CH2
.A有多种合成方法,请写出由乙酸合成A的路线流程图(其他原料任选),合成路线流程图示例如下:H2C=CH2 ![]() CH3CH2OH
CH3CH2OH ![]() CH3COOC2H5 .
CH3COOC2H5 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定. Ⅰ.制备Na2S2O35H2O
反应原理:Na2SO3(aq)+S(s) ![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80mL蒸馏水.另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中.
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60分钟.
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤、洗涤、干燥,得到产品.
回答问题: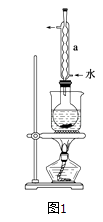
(1)硫粉在反应前用乙醇润湿的目的是 .
(2)仪器a的名称是 , 其作用是 .
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 . 检验是否存在该杂质的方法是 .
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因: .
(5)Ⅱ.测定产品纯度 准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0molL﹣1碘的标准溶液滴定.
反应原理为2S2O ![]() +I2═S4O
+I2═S4O ![]() +2I﹣
+2I﹣
滴定至终点时,溶液颜色的变化:
(6)测定起始和终点的液面位置如图2,则消耗碘的标准溶液体积为mL.产品的纯度为(设Na2S2O35H2O相对分子质量为M) . 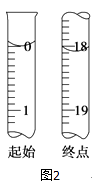
(7)Ⅲ.Na2S2O3的应用 Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ![]() ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人用全钒液流电池:VO2++V2++2H+ ![]() VO2++H2O+V3+ , 在空气中电解水(酸性条件下)的方法,阳极制得臭氧,阴极制得过氧化氢,电解总方程式为3H2O+3O2═3H2O2+O3 , 其中H2O2只为还原产物.下列说法正确的是( )
VO2++H2O+V3+ , 在空气中电解水(酸性条件下)的方法,阳极制得臭氧,阴极制得过氧化氢,电解总方程式为3H2O+3O2═3H2O2+O3 , 其中H2O2只为还原产物.下列说法正确的是( )
A.原电池放电时正极反应为VO2++2H++e﹣═VO2++H2O
B.充电时阴极反应为V2+﹣e﹣═V3+
C.电解池的阴极反应式为3O2+6H2O+6e﹣═3H2O2+6OH﹣
D.电解池中生成22.4 L O3(标准状况)时,转移3 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按题目要求答题:
(1)(CH3)2CHCH(CH3)CH2CH3的系统命名是
(2)写出苯与液溴发生取代反应的化学方程式:
(3)某烃A的相对分子质量为84,能与氢气发生加成反应.A的一氯取代产物只有一种,则A的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( ) 
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为 Zn 和碳棒,则 X 为碳棒,Y 为 Zn
C.若两电极都是金属,则它们的活动性为 X>Y
D.X 极上发生的是还原反应,Y 极上发生的是氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com