
����Ŀ��(NH4)2Fe(SO4)2��6H2O�׳�Ħ����(M��392g��mol-1)�Ƿ�����ѧ����Ҫ�ı����ʣ�ij�о�С��������������պ������(��Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3����������������)Ϊԭ����ȡĦ���Σ�������������̣�
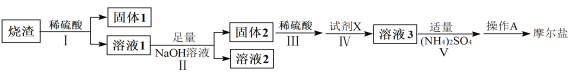
(1)д���Լ�X�Ļ�ѧʽ__________��
(2)д������Һ1����ij��������NaOH��Ӧ��������Һ2�������ӵ����ӷ���ʽ________��
(3)����AΪ����Ũ����_________����ȴ�ᾧ�����ˡ�ϴ�ӡ�������й��˲���������ͼװ�ý��У���ѡ����ʵı�ţ�����ȷ�IJ���˳������(ϴ�Ӳ���ֻ�迼��һ��)������������a��b��d��_________��d��c���س����á�
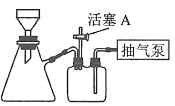
a��ת�ƹ�Һ�����
b���ػ���A
c��������A
d��ȷ�ϳ��
e����ϴ�Ӽ�ϴ��
(4)ʵ���Ƶõ�Ħ���εĴ��ȿ���Ce(SO4)2����Һ�ζ����вⶨ���ζ���ӦΪFe2����Ce4��=Fe3+��Ce3�����ⶨʱ���ȳ�ȡ4.000g��Ʒ�����100mL��Һ��ȡ������20.00mL������ƿ�У�����Һ���б�Ҫ��������0.1000mol��L-1Ce(SO4)2����Һ�ζ����յ㣬��¼�������±���
�ζ����� | 0.1000mol��L-1Ce(SO4)2����Һ���(mL) | |
�ζ�ǰ���� | �ζ������ | |
1 | 0.10 | 20.12 |
2 | 0.12 | 20.10 |
3 | 0.05 | 21.65 |
����Ʒ��Ħ���εĴ���Ϊ__________(������������ʾ������4λ��Ч����)��
�����ζ�������û����ϴ�ζ��ܣ���������Ʒ����______(����ƫ��������ƫ����������Ӱ����)
���𰸡�Fe Al3++4OH��=AlO![]() +2H2O ������־�Ĥ ceb 98.00% ƫ��
+2H2O ������־�Ĥ ceb 98.00% ƫ��
��������
�������պ��������Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3������ϡ���ᣬ�������費����ϡ���ᣬ�����1Ϊ�������裻����������������ϡ���ᷴӦ������������������������Һ1�м�����������������Һ����Ӧ������������NaAlO2�������2Ϊ��������������ϡ����������������Ħ����(NH4)2Fe(SO4)2��6H2O����Ԫ�ػ��ϼ�Ϊ+2�ۣ�����������ۻ�ԭ�����ӣ���Һ3Ϊ����������
(1)���Ϸ����������Լ�X�������ӻ�ԭΪ�������ӣ��ֲ��������µ����ʣ���X�Ļ�ѧʽΪFe��
(2)���Ϸ���������Һ1������������NaOH��Ӧ��������Һ2���е�AlO![]() �����ӷ���ʽΪAl3++4OH��=AlO
�����ӷ���ʽΪAl3++4OH��=AlO![]() +2H2O��
+2H2O��
(3)����A��(NH4)2Fe(SO4)��Һת��Ϊ(NH4)2Fe(SO4)2��6H2O���壬���轫��Һ����Ũ����������־�Ĥ����ȴ�ᾧ�����ˡ�ϴ�ӡ����װ��Ϊ����װ�ã�����˳��Ϊ�������ã�ת�ƹ�Һ�����رջ���A���γ��ܱ�������ȷ�ϳ�ɺ���A��ƽ��������ѹ����ϴ�Ӽ�ϴ�Ӻ�ػ���A�������رջ���A���ˡ�
(4)���ɱ������ݿ�֪������3Ϊ��Ⱥ����Ӧ����������ı���Һ�����Ϊ![]() �����ݷ�Ӧ����ʽFe2����Ce4��=Fe3+��Ce3�������Ʒ��Ħ�������������ӵ����ʵ���Ϊ
�����ݷ�Ӧ����ʽFe2����Ce4��=Fe3+��Ce3�������Ʒ��Ħ�������������ӵ����ʵ���Ϊ![]() ���䴿��Ϊ
���䴿��Ϊ![]() ��
��
�����ζ�������û����ϴ�ζ��ܻᵼ��ʹ�ñ�Һ�����ƫ�ߣ���������Ʒ����ƫ�ߡ�


 ��ѧ��ʦ����ϵ�д�
��ѧ��ʦ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��̼�H2CO3��K1��4.3��10��7��K2��5.6��10��11
���H2C2O4��K1��5.9��10��2��K2��6.4��10��5
0.1mol/L Na2CO3��Һ��pH_____0.1mol/L Na2C2O4��Һ��pH����ѡ������������С����������������
��2����Ũ�ȵIJ�����Һ��̼����Һ�У�������Ũ�Ƚϴ����_____��������Ũ�ȵIJ�����Һ��̼����Һ�������ϣ���Һ�и�������Ũ�ȴ�С��˳����ȷ����_____��ѡ���ţ���
a��c(H+)��c(HC2O![]() )��c(HCO
)��c(HCO![]() )��c(CO
)��c(CO![]() )
)
b��c(HCO![]() )��c(HC2O
)��c(HC2O![]() )��c(C2O
)��c(C2O![]() )��c(CO
)��c(CO![]() )
)
c��c(H+)��c(HC2O![]() )��c(C2O
)��c(C2O![]() )��c(CO
)��c(CO![]() )
)
d��c(H2CO3)��c(HCO![]() )��c(HC2O
)��c(HC2O![]() )��c(CO
)��c(CO![]() )
)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����������ʵ����ƫ�ߵ��ǣ� ��
A.�ⶨ����ͭ�����нᾧˮ������ʵ���У����������ȫʧȥ�ᾧˮ��ʢ��������������ʵ������������ȴ
B.��п��Ƥп�Ʋ��Ȳ���ʵ���У�����Ƥ�þƾ��Ƴ�����ǿ���Գ����
C.�ñ���ζ���������Һʱ��װ�б���ĵζ��ܵζ�ǰ�����ݣ��ζ���������
D.һ�����ʵ���Ũ�ȵ��������ƹ���������Ͳ��ȡ���������Ũ����ʱ�����ӹ۲�̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ��屽�ķ�Ӧװ������ͼ��ʾ������ʵ������������������
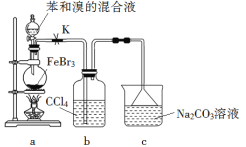
A. ��Բ����ƿ�еμӱ�����Ļ��Һǰ���ȴ�K
B. ʵ����װ��b�е�Һ����Ϊdz��ɫ
C. װ��c�е�̼������Һ�������������廯��
D. ��Ӧ��Ļ��Һ��ϡ����Һϴ�ӡ��ᾧ���õ��屽
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL 0.1mol��L-1����������μ���0.1 mol��L-1�İ�ˮ����ҺpH�ı仯����백ˮ�������ϵ��ͼ��ʾ��������������ȷ����
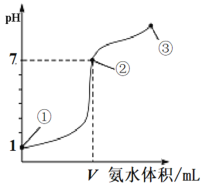
A.V��20 mL
B.�١��ڡ��۵�ˮ�ĵ���̶ȴ�СΪ���ڣ��ۣ���
C.�ڵ����ʾ��Һ�У�c(Cl��)��c(NH3��H2O)��c(NH![]() )
)
D.�ڵ�ڡ���֮����ܴ��ڣ�c(NH![]() )��c(Cl��)��c(OH��)��c(H+)
)��c(Cl��)��c(OH��)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
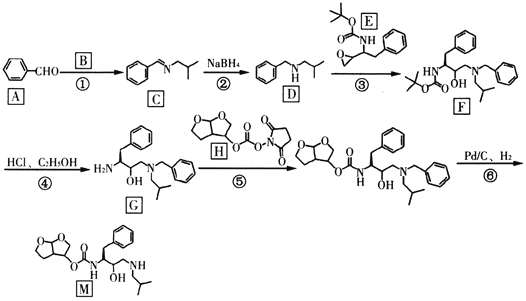
����Ŀ������«��Τ���ǿ�������״����DZ����ҩ��������M�����ĺϳ��м��壬��ϳ�·�����£�
��֪��R1CHO![]()
![]()
�ش��������⣺
(1)�л���A��������______________����Ӧ�ڷ�Ӧ������__________��
(2)����B�Ľṹ��ʽ��____________��E�ķ���ʽΪ_____________��
(3)G�к��������ŵ�������________��F����________������̼ԭ�ӡ�
(4)��д����Ӧ�ݵĻ�ѧ��Ӧ����ʽ_____________��
(5)����N��C��һ��ͬ���칹�壬д����������������һ��ͬ���칹��Ľṹ��ʽ_______��
�ٷ��ӽṹ�к��б����Ͱ����������뱽��ֱ������������ʹ��ˮ��ɫ���ۺ˴Ź���������6��壬�����֮��Ϊ6��3��2��2��1��1��
(6)����ɱ��״���CH3NH2Ϊԭ���Ʊ�![]() �ĺϳ�·��_______________��
�ĺϳ�·��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̫���ܵ���е�����̫���ܵ�ء��ྦྷ��̫���ܵ�ء�![]() ̫���ܵ�ؼ�ͭ��������Ĥ̫���ܵ�صȡ�
̫���ܵ�ؼ�ͭ��������Ĥ̫���ܵ�صȡ�
��1����̬![]() ԭ�ӵļ۲�����Ų�ʽΪ_______________��
ԭ�ӵļ۲�����Ų�ʽΪ_______________��
��2��������![]() ����ת��Ϊ
����ת��Ϊ![]() ���Դ�ԭ�ӽṹ�ǶȽ���ԭ��_______________��
���Դ�ԭ�ӽṹ�ǶȽ���ԭ��_______________��
��3���Ҵ��ķе��������ķе㣬��ԭ����______________��
��4��![]() �����幹��Ϊ________��
�����幹��Ϊ________��
��5������![]() �������ܵ����
�������ܵ����![]() ����ˮ�����һ��
����ˮ�����һ��![]() ����
����![]() �������������ԡ�
�������������ԡ�
��![]() �к�����λ���������ṩ�չ������________����Ԫ�ط��ţ���
�к�����λ���������ṩ�չ������________����Ԫ�ط��ţ���
��![]() �ĽṹʽΪ________��
�ĽṹʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ӫ�������п(ZnS)���о��������� 150 �������ʷ���������ư�ɫ���ϡ�����ۡ���������ȣ��������ʪ�������ױ�����Ϊ ZnSO4����ش��������⣺
(1)��̬ Zn ԭ�ӵĵ����Ų�ʽΪ_________________________���������ռ������ܲ�ķ�����__________________________�� ռ�ݸ��ܲ���ӵĵ���������ͼ��״Ϊ__________________________��
(2)ZnSO4 ������Ԫ�صĵ縺���ɴ�С��˳��Ϊ__________________________��![]() �����幹��Ϊ__________________________������ S ���ӻ��������Ϊ__________________________��
�����幹��Ϊ__________________________������ S ���ӻ��������Ϊ__________________________��
(3)ZnSO4 ���ڰ�ˮ������[Zn(NH3)4]SO4 ��Һ��[Zn(NH3)4]SO4 ��Һ�в����ڵ�������������__________________________��
A�����Ӽ�B�����ۼ�C����λ��D�����»���
(4)��������п±������۵���ܽ��ԣ��ж� ZnF2 ���������Ϊ______������ ZnCl2��ZnBr2��ZnI2 �۵����������ԭ��__________________________��
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
�۵�/�� | 872 | 275 | 394 | 446 |
���Ҵ��������е��ܽ��� | ���� | �ܽ� | �ܽ� | �ܽ� |
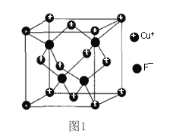
(5) ���� ZnS ������ܶ�Ϊ �� g/cm3���侧���ṹ��ͼ��

S2����Χ�Ⱦ���������� Zn2��Ϊ__________________________��ZnS�����еľ������� a��__________________________nm(�г�����ʽ)��[ M(ZnS)��97 g/mol ]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.�����仯������;�dz��㷺���ش��������⣺
(1)���ķ���ϩ��Ʒ����Ϊ���ط�������������ճ��Ϳ�㡣����һ�����壬�þ�����һ����ƽ�����������ϸ�����λ����Ķ��ؾ��塣��ͨ��____________�������־��塢����ͷǾ��塣
(2)��(Sb)���鴦��ͬһ���������ڣ���̬��ԭ�Ӽ۵����Ų�ʽΪ______��[H2F]+[SbF6]-(������)��һ�ֳ�ǿ�ᣬ����[H2F]+��д��һ����[H2F]+��Ϊ�ȵ��������������_________��
(3)����(H3BO3)���ķ������(NH4BF4)��������Ҫ�Ļ�����;��
��H3BO3��NH4BF4�漰������Ԫ���еڶ�����Ԫ�صĵ�һ�������ɴ�С��˳��____(��Ԫ�ط���)��
��H3BO3�������ܵ����H+����ˮ�����һ��OH������[B(OH)4]���������������ԡ�[B(OH)4]����Bԭ�ӵ��ӻ�����Ϊ_________��
��NH4BF4(�ķ������)����������ͭ�������ۼ����ܸ�ʴ�����ȡ��ķ�������д���_______(�����)��
A ���Ӽ� B ���� C ���� D ���»��� E ��λ��
(4)CuCl���۵�Ϊ426�����ۻ�ʱ���������磻CuF���۵�Ϊ908����
��CuF��CuCl�۵�ߵ�ԭ����_____________��
��CuF�ľ����ṹ��ͼ1��F-�����Cu+Χ�ɵ�_______��϶�У���϶�����Ϊ________%��
��.AA705�Ͻ�(��Cu��Al��Zn��Mg��Ti)�������һ����̣���������Ϊ�ֵ�����֮һ���ѱ����ڷɻ������ͻ����������ֻ�����ϵȡ�
(5)CN-��NH3��H2O��OH-�����嶼����Zn2+�γ������ӡ�1mol [Zn(NH3)4]2+��________ mol�������������ӵ���λ��Ϊ__________��
�Ѿ���������Ʒ������ͼ��ʾ��
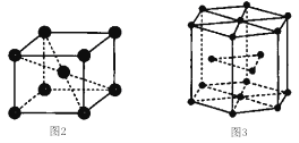
����ͼ2��ʾ�������Ŀռ�������Ϊ______(�ú�����ʽ�ӱ�ʾ)��
����֪ͼ3���������߳�Ϊx pm����Ϊy pm�����Ѿ����ܶ�ΪD g��cm-3��NAΪ______mol-1(�ú�x y��D��ʽ�ӱ�ʾ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com