
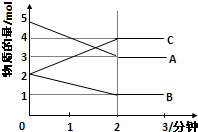
 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是

科目:高中化学 来源: 题型:
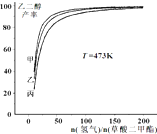 发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值.以下是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:
发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值.以下是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:| 水蒸气 |
| 高温 |
| 氧化偶联 |
| 催化还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
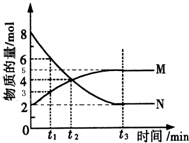 在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
| A、2:3 | B、4:3 |
| C、10:3 | D、11:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com