
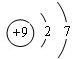 ,B为Na,钠离子核外有2个电子层、最外层8个电子,其钠离子结构示意图为
,B为Na,钠离子核外有2个电子层、最外层8个电子,其钠离子结构示意图为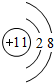 ,
,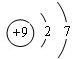 ;Na;
;Na;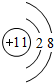 ;
;

科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 5.4 | 4.0 | 6.5 |
| 完全沉淀 | 3.7 | 9.6 | 6.4 | 5.2 | 8.0 |
| c(Fe2-) |
| c(Cu2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Na | Mg | Al | ||
| 与冷水反应 | 现象 | |||
| 化学方程式 | ||||
| 与沸水反应 | 现象 | |||
| 化学方程式 | ||||
| 结论 | ||||
| 最高价氧化物对应的水化物碱性强弱 | NaOH | Mg(OH)2 中强酸 | Al(OH)3 | |
| Mg | Al | |
| 现象 | ||
| 反应方程式 |
| Si | P | S | Cl | |
| 单质与氢气反应的条件 | 高温 | 磷蒸气与氢气能反应 | 加热 | 光照或点燃时发生爆炸而化合 |
| 最高价氧化物对应的水化物(含氧酸)酸性强弱 | H2SiO3 弱酸 | H3PO4 中强酸 | H2SO4 强酸 | HClO4 强酸 (比H2SO4酸性强) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 物质的摩尔质量(g/mol) | 质量 | 0℃密度(g/cm3) | 体积(cm3) |
| Fe | 55.85 | 7.8 | ||
| Al | 26.98 | 2.7 | ||
| H2O | 18 | 1.0 | ||
| H2SO4 | 98 | 1.83 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在温度为373K时,将0.100mol无色的N2O4气体通入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O42NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体通入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O42NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)| T/K | 323 | 373 |
| K值 | 0.022 | ? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com