
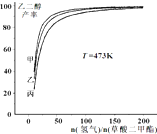
 发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值.以下是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:
发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值.以下是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:| 水蒸气 |
| 高温 |
| 氧化偶联 |
| 催化还原 |
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
| 3 |
| 2 |
| 3 |
| 2 |
| 32g |
| 32g/mol |
| 6mol |
| 8 |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| A、Li不能在氮气中燃烧 |
| B、Li2O熔点较低 |
| C、Li2CO3易溶于水 |
| D、LiOH受热易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
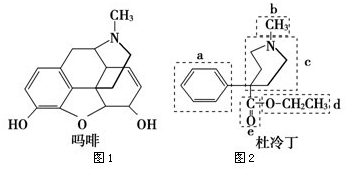
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素符号 | Li | Be | B | C | O | F |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素符号 | Na | Al | Si | P | S | Cl |
| x值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 5.4 | 4.0 | 6.5 |
| 完全沉淀 | 3.7 | 9.6 | 6.4 | 5.2 | 8.0 |
| c(Fe2-) |
| c(Cu2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
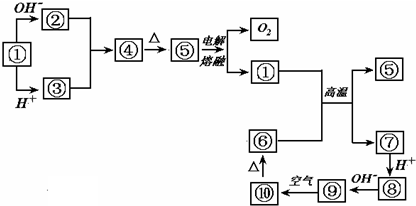
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com