
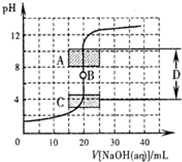
 酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其间溶液的pH变化是判断滴定终点的依据.
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其间溶液的pH变化是判断滴定终点的依据.| 实验序号 | 消耗0.1032mol?L-1的盐酸溶液的体积/mL | 待测氢氧化钠溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
| c(HCl)?V(HCl) |
| V(NaOH) |
| 27.83mL+27.85mL |
| 2 |
| c(HCl)?V(HCl) |
| V(NaOH) |
| 0.1032mol/L×0.0250L |
| 0.02784L |


科目:高中化学 来源: 题型:
| 四种物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量(g) | 25 | 15 | 1 | 5 |
| 反应后质量(g) | 11 | 未测 | 1 | 22 |
| A、该反应是复分解反应 |
| B、丙一定是催化剂 |
| C、乙全部发生了反应 |
| D、甲与乙反应的质量比为14:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
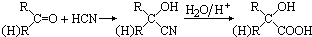 ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成: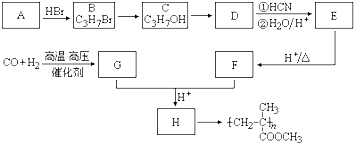
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
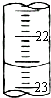 为了测定某NaOH样品中NaOH的质量分数(杂质不参与反应),某化学兴趣小组进行了如下实验:
为了测定某NaOH样品中NaOH的质量分数(杂质不参与反应),某化学兴趣小组进行了如下实验:| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.00 | 21.01 |
| 2 | 25.00 | 2.00 | 24.00 |
| 3 | 25.00 | 0.20 | 20.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的
| ||
| B、两途径最终达到平衡时,体系内混合气的百分组成相同 | ||
| C、达平衡时,途径Ⅰ的反应速率v(A)等于途径Ⅱ的反应速率v(A) | ||
| D、两途径最终达到平衡时,体系内混合气的百分组成不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com