
【题目】如图为氯及其化合物的“价-类”二维图。
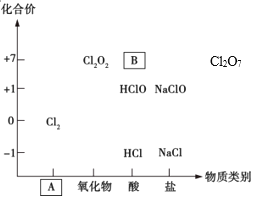
(1)填写二维图缺失的类别A_________和化学式B_________。
(2)某同学利用以下试剂研究HCl性质,进行了如下预测:
a.NaClO b.Fe c.NaOH d.KMnO4 e.AgNO3
从物质类别上看,HCl属于______,可能与__________发生反应(填序号);
从化合价角度看,Cl-具有______性,可能与_____发生反应(填序号)。
(3)某工厂用NaCl溶液制备氯气,其化学原理为如下反应:
![]() H2O +
H2O + ![]() NaCl == Cl2 +
NaCl == Cl2 + ![]() NaOH+
NaOH+![]()
①请将上述方程式补充完整,并用单线桥表示电子转移。_____________
②反应中NaCl作_________剂,理由是_________________________________。
【答案】单质 HClO4 酸 a、b、c、e 还原 a、d 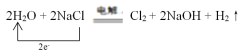 还原 因为其中氯由-1价上升为0价(或在反应中失去电子)
还原 因为其中氯由-1价上升为0价(或在反应中失去电子)
【解析】
(1)Cl2为单质;根据B中Cl元素化合价进行判断;
(2)HCl属于强电解质,完全电离,所有的阳离子均为H+,因此HCl属于酸,能与碱、金属单质、等发生反应;Cl-中Cl为-1价,为最低价态,具有还原性,据此分析作答;
(3)①根据氧化还原反应化合价升降守恒对方程式进行配平,并判断电子转移数目;
②根据方程式中化合价的变化判断。
(1)Cl2为单质,因此A为单质;物质B中Cl为+7价,Cl为+7价的酸为HClO4;
(2)HCl属于强电解质,完全电离,所有的阳离子均为H+,因此HCl属于酸,能与NaClO反应生成HClO,能与铁反应生成氢气,能与氢氧化钠发生中和反应,能与AgNO3反应生成白色沉淀;Cl-中Cl为-1价,为最低价态,具有还原性,能与NaClO发生归中反应,能与KMnO4发生氧化还原反应;
(3)①根据氧化还原反应化合价升降守恒对方程式配平可得方程式为2H2O+2NaCl![]() Cl2+2NaOH+H2↑,2molNaCl参与反应,电子转移2mol,用单线桥表示为:
Cl2+2NaOH+H2↑,2molNaCl参与反应,电子转移2mol,用单线桥表示为:
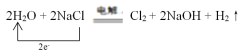 ;
;
②由方程式可知,反应中Cl由-1价变为0价,化合价升高,失去电子,被氧化,NaCl作还原剂。


科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(![]() )是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
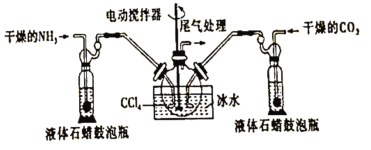
(1)制备氨基甲酸铵的化学方程式为____________
(2)三颈烧瓶用冰水冷却的原因是______________
(3)液体石蜡鼓泡瓶的作用是_______________
(4)水是很好的溶剂,且可以大量吸收反应混合气体,该反应中是否可用水作溶剂:________(填“是”或“否”),理由:___________
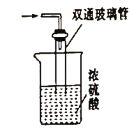
(5)尾气处理装置如图所示,双通玻璃管的作用是_________,浓硫酸的作用是________
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为1.00 g。则样品中氨基甲酸铵的质量分数为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH-,工作原理如图所示。下列说法错误的是( )
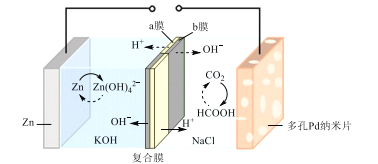
A.a膜是阳离子膜,b膜是阴离子膜
B.放电时负极的电极反应式为Zn+4OH--2e-=Zn(OH)42-
C.充电时CO2在多孔Pd纳米片表面转化为甲酸
D.外电路中每通过1mol电子,复合膜层间有1mol H2O解离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柔红酮是一种医药中间体,其结构简式如图所示。下列说法正确的是( )
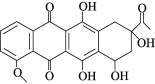
A.每个柔红酮分子中含有2个手性碳原子
B.一定条件下柔红酮可发生消去、氧化、加成、取代反应
C.1 mol柔红酮最多可与2 mol Br2发生取代反应
D.柔红酮分子中所有的碳原子有可能都在同一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO与N2O在铁催化剂表面进行如下两步反应,其相对能量与反应历程如图所示。
第一步:Fe*+N2O=FeO*+N2
第二步:FeO*+CO=Fe*+CO2
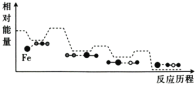
下列叙述错误的是( )
A.Fe*是反应的催化剂
B.两步反应的ΔH均小于0
C.第一步反应比第二步反应快
D.总反应为CO+N2O=N2+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mlNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
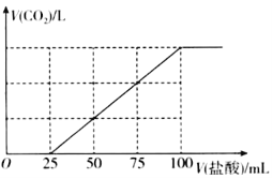
A.通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaHCO3):n(Na2CO3)=1:1
B.通入CO2在标准状况下的体积为448mL
C.通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=1:3
D.原NaOH溶液的浓度为0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于东莨菪内酯(![]() )的说法,不正确的是( )
)的说法,不正确的是( )
A.该物质中含有三种含氧官能团
B.该物质能发生氧化、取代、加成反应
C.0.1mol该物质与足量浓溴水反应,最多可消耗0.3molBr2
D.0.1mol该物质与足量NaOH溶液反应,最多可消耗0.3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.将标况下22.4LCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
B.1.0molCH4与Cl2在光照下反应生成的CH3Cl分子数为NA
C.某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA
D.常温常压下,20gD218O分子中所含质子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com