
【题目】将一定质量的Mg和Al的混合物投入2.0mol/L,250 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示。则下列说法正确的是( )

A.当加氢氧化钠溶液体积为20mL时,溶液的pH值等于7
B.当加氢氧化钠溶液体积为20mL时,溶液中的溶质只有硫酸镁和硫酸铝
C.NaOH溶液的物质的量浓度为5 mol/L
D.生成的H2在标准状况下的体积为11.2 L
【答案】C
【解析】
根据图象可知,从开始至加入NaOH溶液20mL时没有沉淀生成,说明在反应中硫酸是过量的。加入的氢氧化钠首先中和剩余的硫酸,反应的化学方程式为H2SO4+2NaOH=Na2SO4+2H2O。继续加入氢氧化钠,此时开始出现沉淀,发生的反应为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓。当沉淀达到最大值时再加入氢氧化钠,此时氢氧化铝开始溶解,反应的方程式为NaOH+Al(OH)3=NaAlO2+2H2O。当沉淀不再减少时,所得沉淀全部为Mg(OH)2,物质的量为0.15mol,则Al(OH)3的物质的量=0.35mol-0.15mol=0.2mol,据以上分析解答。
根据图象可知,从开始至加入NaOH溶液20mL时没有沉淀生成,说明在反应中硫酸是过量的。加入的氢氧化钠首先中和剩余的硫酸,反应的化学方程式为H2SO4+2NaOH=Na2SO4+2H2O。继续加入氢氧化钠,此时开始出现沉淀,发生的反应为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓。当沉淀达到最大值时再加入氢氧化钠,此时氢氧化铝开始溶解,反应的方程式为NaOH+Al(OH)3=NaAlO2+2H2O。当沉淀不再减少时,所得沉淀全部为Mg(OH)2,物质的量为0.15mol,则Al(OH)3的物质的量=0.35mol-0.15mol=0.2mol,
A、当V(NaOH溶液)=20mL时,溶质有硫酸镁、硫酸铝和硫酸钠,铝离子水解,溶液呈酸性,A错误;
B、根据以上分析可知由图象可知,当加氢氧化钠溶液体积为20mL时,溶液中的溶质有硫酸镁、硫酸铝和硫酸钠,B错误;
C、沉淀量最大时溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(NaOH)=2n(Na2SO4)=2×0.25L×2mol/L=1mol,所以NaOH溶液的物质的量浓度为![]() =5 mol/L,C正确;
=5 mol/L,C正确;
D、根据镁原子和铝原子守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol。则根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg)=3×0.2mol+2×0.15mol=0.9mol,因此n(H2)=0.45mol,所以在标准状况下氢气体积为0.45mol×22.4mol/L=10.08L,D错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】近年来,雾霾天气成为我国华北地区乃至全国的环境问题之一。
Ⅰ汽车尾气是空气污染的重要原因。汽车尾气净化原理为:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H <0。
2CO2(g)+N2(g) △H <0。
(1)该反应的平衡常数表达式为____________________。
(2)在一恒容的绝热容器(不与外界发生热交换)中模拟上述反应。下面各示意图正确且能说明反应在t1时刻达到平衡状态的是__________。
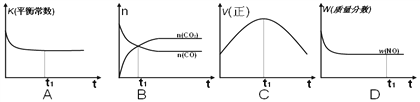
Ⅱ煤燃烧产生的烟气中含有大量硫、氮的氧化物,会引起严重的环境污染问题。
(1) 硫、氮的氧化物都会形成酸雨。为减少酸雨产生,下列措施中不可行的有_______(填序号)。
a.少用煤作燃料 b.把工厂的烟囱加高 c.燃料脱硫
d.燃煤时鼓入足量空气 e.开发新能源
(2)煤燃烧产生的氮的氧化物可以用CH4催化还原。已知:
CH4(g) + 2NO2(g) = N2(g) +CO2(g) + 2H2O(g) △H =-867kJ/mol
2NO2(g) = N2O4(g) △H =-56.9kJ/mol
H2O(l) = H2O(g) △H =+44kJ/mol
写出CH4(g) 还原N2O4(g)生成N2(g) 、CO2(g)和H2O(l)的热化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二元酸H2X易溶于水
(1)常温下,向0.1mol/L的酸式盐NaHX的溶液中滴入几滴紫色石蕊试液,溶液变成红色。
①若测得此溶液的pH=1,则NaHX溶于水时的电离方程式为__________
②若NaHX溶液中能检测到H2X分子,则溶液中c(X2-)__________(填>、<或=)c(H2X),c(X2-)+c(HX-)+c(H2X)=__________mol/L
(2)常温下,0.1mol/LNaHX溶液中存在的离子有Na+、X2-、HX-、H+、OH-,存在的分子只有H2O,且c(H+)=0.01mol/L
①该溶液中c(HX-)+c(X2-)=__________mol/L
②常温下,0.1mol/LH2X溶液中c(H+)________(填>、<或=)0.11mol/L
(3)若NaHX溶液中检测不到H2X分子但可检测到HX-,则溶液中c(H+)-c(OH-)________(填>、<或=)c(X2-),若HX-的电离平衡常数K=2.5×10-6,则0.4mol/L的NaHX溶液的pH约为__________
(4)常温下向20mL 0.05mol/L某稀酸H2X溶液中滴入0.1mol/L氨水,溶液中由水电离出来的氢离子浓度随滴入氨水体积变化如图,下列分析正确的是________(填字母代号)
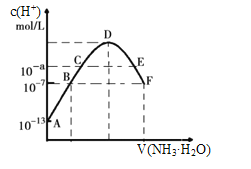
A.NaHX溶液可能为酸性,也可能为碱性
B.A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C.E点溶液中离子浓度大小关系:c(NH4+)>c(X2-)>c(OH-)>c(H+)
D.F点溶液:c(NH4+)=2c(X2-)
(5)已知某混合溶液中含有4molNa2X、2molNa2CO3和1molNaHCO3。往溶液中通入4molCO2气体,充分反应后气体全部被吸收,反应后Na2CO3和NaHCO3的物质的量分别为________,________(不考虑弱酸根离子的电离及水解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
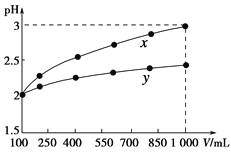
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl—)与c(SO42—)之比为( )

A. 1∶1 B. 2∶3 C. 3∶2 D. 2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2反应速率为0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃,将amolN2和bmolO2充入体积为IL的密闭容器中发生反应: N2(g)+O2(g)=2NO(g)△H=181.5kJ/mol,反应过程中v正与v逆的变化如图所示。下列说法正确的是

A.若t1时NO为cmol,则0~t1时间段内平均反应速率v(N2)=
B.t1~t2时间段内v正(O2)=2v逆(NO)
C.图中所示的阴影部分面积的含义是v正与v逆的差
D.其他条件不变,t2时刻升高温度,v正与v逆均增大,且v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温、常压下,50 mL三种气态烃的混合物与足量的氧气混合后点燃爆炸,恢复到原来状况时,体积共缩小100 mL,则三种烃可能是
A.CH4、C2H6、C3H4B.C2H6、C3H6、C4H6
C.CH4、C2H6、C3H8D.C2H4、C2H6、C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热为 890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol
B. 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △H = -38.6 kJ/mol
2NH3(g) △H = -38.6 kJ/mol
C. 稀盐酸和 稀氢氧化钠溶液混合, 其热化学方程式为:H+(aq)+OH-(aq)=H2O(1) △H = -57.3 kJ/mol
D. 1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(1)△H =+285.8 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com