
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用Al2O3(熔点2045℃)和冰晶石(Na3AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(1)铝属于活泼金属却能在空气中稳定存在,原因是____(用化学用语及相关文字说明)。
(2)将0.1mo/LAlCl3溶液和10%NH4F溶液混合制取Na3AlF6。该实验所用试管及盛装NaF溶液的试剂瓶均为塑料材质,原因是____(用离子方程式表示)。
(3)下列关于氧化铝的叙述正确的是_____。
A.氧化铝可以治疗胃酸过多 B.氧化铝因为熔点高,可以作耐火材料
C.氧化铝是铝热剂的成分之一 D.氧化铝是天然蓝宝石的主要成分
(4)以Al 和NiO(OH)为电极,NaOH 溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是________。
(5)某工厂排放出有毒物质NOC1,它遇水就会生成NO3-。NOCl 分子中各原子均满足8电子稳定结构,则NOCl的电子式为____。水源中的NO3-对人类健康会产生危害,为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为____。
【答案】 4Al+3O2=2Al2O3,在空气中铝的表面能够形成一层致密的氧化膜 F-+H2O![]() HF+OH- BD Al+3NiO(OH)+H2O==NaAlO2+3Ni(OH)2
HF+OH- BD Al+3NiO(OH)+H2O==NaAlO2+3Ni(OH)2 ![]() 10Al+6NO3-+4OH-==3N2+10AlO2-+2H2O
10Al+6NO3-+4OH-==3N2+10AlO2-+2H2O
【解析】(1)铝在空气中稳定存在,其原因是常温下Al与氧气反应,铝表面形成致密的氧化膜,能保护内层金属不被氧化,反应的化学方程式为4Al+3O2=2Al2O3。
故答案为:4Al+3O2=2Al2O3,在空气中铝的表面能够形成一层致密的氧化膜。
(2)NH4F中的F-水解生成HF,水解方程式为F-+H2OHF+OH-。氢氟酸与玻璃中的二氧化硅反应,对玻璃有强烈的腐蚀作用,氢氟酸对塑料无腐蚀性。所以该实验所用试管及盛装NaF溶液的试剂瓶均为塑料材质。故答案为:F-+H2OHF+OH-。
(3)A、一般用氢氧化铝作胃药,而不用氧化铝,故A错误;B、氧化铝熔点高,是优良的耐火材料,故B正确;C、铝热剂为铝和其他金属氧化物(例如Fe2O3、MnO2等),氧化铝是铝热反应的产物,故C错误;D、红宝石、蓝宝石的主成份皆为氧化铝,因为其它杂质而呈现不同的色泽,蓝宝石因含有氧化铁和氧化钛而呈蓝色,故D正确。故选BD。
(4)以Al 和NiO(OH)为电极,NaOH 溶液为电解液,放电时NiO(OH)转化为Ni(OH)2,Al 作负极失电子,在NaOH溶液中生成NaAlO2。每1molAl失去3mol电子,每1mol NiO(OH)得到1mol电子,则Al与NiO(OH)的计量系数之比为1∶3。该电池的化学方程式为:Al+3NiO(OH)+H2O==NaAlO2+3Ni(OH)2 。
(5)NOCl分子中各原子均满足8电子稳定结构,则N原子与O原子共用两对电子,N原子与Cl原子共用一对电子,则电子式为![]() 。根据题干信息反应物为Al、NO3-、OH-,碱性条件下,Al应被转化为AlO2-。Al元素化合价由0价升高到+3价,共升高3价;NO3-中N元素被还原为0价,共降低5价,化合价升降最小公倍数为15,则Al与NO3-的计量系数之比为5∶3;又因为2个NO3-生成1个N2,则Al与NO3-的计量系数可以分别为10、6,则有10Al+6NO3-+ OH-—3N2+10AlO2-,再根据原子守恒和电荷守恒,配平方程式,可得10Al+6NO3-+4OH-=3N2+10AlO2-+2H2O。
。根据题干信息反应物为Al、NO3-、OH-,碱性条件下,Al应被转化为AlO2-。Al元素化合价由0价升高到+3价,共升高3价;NO3-中N元素被还原为0价,共降低5价,化合价升降最小公倍数为15,则Al与NO3-的计量系数之比为5∶3;又因为2个NO3-生成1个N2,则Al与NO3-的计量系数可以分别为10、6,则有10Al+6NO3-+ OH-—3N2+10AlO2-,再根据原子守恒和电荷守恒,配平方程式,可得10Al+6NO3-+4OH-=3N2+10AlO2-+2H2O。
故答案为:![]() ;10Al+6NO3-+4OH-=3N2+10AlO2- +2H2O。
;10Al+6NO3-+4OH-=3N2+10AlO2- +2H2O。


科目:高中化学 来源: 题型:
【题目】实验室用铁粉制备摩尔盐的操作流程如下:
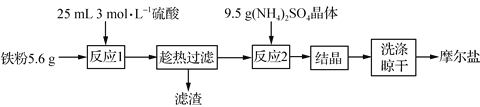
(1)流程中“趁热”过滤的原因是__________。
(2) 反应1制得硫酸亚铁的物质的量理论上应小于__________mol。
(3)为确定摩尔盐的化学式,进行如下实验:现称取4.704 g新制摩尔盐,溶于水配制成100.0 mL溶液,再将该溶液分成两等份。
向其中一份溶液中加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸
变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色,用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体2.796 g。
另一份溶液用0.050 0 mol·L-1 K2Cr2O7酸性溶液滴定,当Cr2O![]() 恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为20.00 mL。
恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为20.00 mL。
①25℃时,Ksp(BaSO4)=1.1×10-10,若要使溶液中SO![]() 离子沉淀完全(即该离子浓度须小于1×10-5 mol·L-1),则此时c[(Ba(OH)2]≥__________mol·L-1。
离子沉淀完全(即该离子浓度须小于1×10-5 mol·L-1),则此时c[(Ba(OH)2]≥__________mol·L-1。
②确定该摩尔盐的化学式(写出计算过程)。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面两种气体的原子数一定相等的是( )
A.质量相等,密度不同的氮气和一氧化碳
B.体积相等,密度相等的氮气和氢气
C.在温度相同、体积相等的条件下氧气和氮气
D.在压强相同、体积相等的条件下氧气和氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,下列除杂![]() 括号内物质为杂质
括号内物质为杂质![]() 的方法正确的是
的方法正确的是![]()
![]()
A. 溴苯(溴):加入KI溶液,振荡,分液
B. 乙烷(乙烯):通过盛有![]() 溶液的洗气瓶
溶液的洗气瓶
C. 硝基苯(浓HNO3):将其倒入足量NaOH溶液中,振荡、静置,分液
D. 乙烯(SO2):通过盛有溴水的洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①离子化合物中可能含有共价键 ②构成晶体的粒子一定含有共价键 ③共价化合物中不可能含有离子键 ④晶体中含阳离子时一定含阴离子。
A. ①②
B. ①③
C. ②④
D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是![]()
![]()
A. 1mol苯分子中含有C=C双键数目为3NA
B. 标准状况下,11.2LCCl4中含有的共价键数目为2NA
C. 1mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3NA
D. 常温常压下,17g羟基含有的电子总数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)——空气燃料电池的工作原理如图所示。电池工作时,下列说法不正确的是
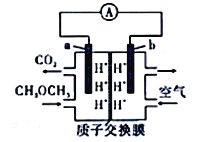
A. b极反应式:O2+H2O+4e-==4OH-
B. a极反应式:CH3OCH3+3H2O-12e-==2CO2↑+12H+
C. b极区溶液的pH变大
D. 每消耗1mol CH3OCH3,有12mol H+向右侧移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com