
【题目】实验室利用硫铁矿烧渣(主要含 Fe2O3、SiO2 等)制备碱式硫酸铁[Fea(OH)b (SO4)c]溶液, 并测定其组成。

(1)酸浸时反应的化学方程式为___。
(2)操作 a 的名称为___,X 为___(填化学式)。
(3)加 CaCO3 调节溶液的 pH,其目的是中和溶液中的酸,并使 Fe2(SO4)3 转化为 Fea(OH)b (SO4)c。若溶 液的 pH 偏高,将会导致溶液中铁元素的含量降低,其原因是___(用文字表述)。
(4)为测定碱式硫酸铁的组成,取一定量样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的 BaCl2 溶液,得到白色沉淀 1.7475 g。另一份溶液,先将 Fe3+还原为 Fe2+,充分反应后向溶液中滴加 0.02000 mol·L-1 K2 Cr2O7溶液,完全反应时消耗K2 Cr2O7溶液 50.00 mL。求该样品的化学式(已知:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O)__________________。(请写出计算过程)
【答案】Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 过滤 SiO2 溶液的pH偏高,将会导致溶液中的铁元素形成Fe(OH)3沉淀 n(SO42-)=n(BaSO4)=1.7475g÷233g/mol=0.0075mol
由Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可知:6Fe2+~Cr2O72-,则碱式硫酸铁中n(Fe3+)=0.02mol/L×0.05Lmol×6=0.006mol
根据电荷守恒3n(Fe3+)=2n(SO42-)+n(OH-),则n(OH-)=0.006mol×3-0.0075mol×2=0.003mol
碱式硫酸铁中n(Fe3+):n(OH-):n(SO42-)=0.006mol:0.003mol:0.0075mol=4:2:5
所以碱式硫酸铁的化学式为Fe4(OH)2(SO4)5
【解析】
硫铁矿烧渣(主要含Fe2O3、SiO2等)和稀硫酸混合,发生反应Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,SiO2和稀硫酸不反应,过滤得滤渣为SiO2,滤液中含有Fe2(SO4)3,加入CaCO3粉末,调节溶液的pH,发生反应生成CaSO4、碱式硫酸铁溶液和CO2,滤渣的成分主要为CaSO4,过滤得滤液,Fe2(SO4)3转化为Fea(OH)b(SO4)c。
(1)酸浸过程中氧化铁和硫酸反应生成硫酸铁和水;
(2)根据分析可知,操作a为过滤,X为SiO2;
(3)若溶液的pH偏高,溶液中的Fe3+和OH-发生离子反应生成Fe(OH)3沉淀使溶液中铁元素的含量降低;
(4)根据碱式硫酸铁[Fea(OH)b(SO4)c]中铁离子和硫酸根离子的守恒,计算出碱式硫酸铁中Fe3+和硫酸根离子的物质的量,再根据电荷守恒计算OH-的物质的量,从而求得该样品的化学式。
(1)通过分析可知,酸浸时反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,故答案为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。
(2)二氧化硅和硫酸不反应,所以X的成分为SiO2,操作a为过滤,故答案为:过滤,SiO2。
(3)通过分析可知,若溶液的pH偏高,溶液中的Fe3+和OH-发生离子反应生成Fe(OH)3沉淀使溶液中铁元素的含量降低,故答案为:溶液的pH偏高,将会导致溶液中的铁元素形成Fe(OH)3。
(4)n(SO42-)=n(BaSO4)=1.7475g÷233g/mol=0.0075mol
由Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可知:6Fe2+~Cr2O72-,则碱式硫酸铁中n(Fe3+)=0.02mol/L×0.05Lmol×6=0.006mol
根据电荷守恒3n(Fe3+)=2n(SO42-)+n(OH-),则n(OH-)=0.006mol×3-0.0075mol×2=0.003mol
碱式硫酸铁中n(Fe3+):n(OH-):n(SO42-)=0.006mol:0.003mol:0.0075mol=4:2:5
所以碱式硫酸铁的化学式为Fe4(OH)2(SO4)5。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将下列各组物质按单质、氧化物、酸、碱分类顺序排列,其中正确的是
A. 氧气、干冰、硫酸、烧碱 B. 碘酒、冰、盐酸、烧碱
C. 氢气、二氧化硫、硝酸、纯碱 D. 铜、硫酸钠、醋酸、石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
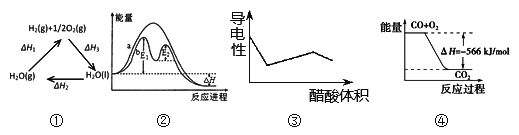
A. 图①中△H1=△H2+△H3
B. 图②在催化剂条件下,反应的活化能等于E1+E2
C. 图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的导电性变化曲线
D. 图④可表示由CO(g)生成CO2(g)的反应过程和能量关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据实验操作及现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3 > C12 |
C | 向待测液中依次滴入氯水和KSCN 溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实描述不正确的是
A. 高溫煅烧石灰石的反应中,反应物总能量高于生成物总能量
B. 中和反应中,反应物总能量高于生成物总能量
C. 铝粉和盐酸反应时,溶液温度通常会上升
D. 氢氧化钡晶体和氯化铵晶体的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
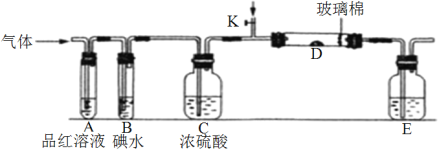
①若从左端分别通入SO2和Cl2,装置A中观察到的现象_________(填“相同或不相同”);若装置D中装的是V2O5(催化剂)。通入SO2时,打开K通入适量O2的化学反应方程式为__________________________________。
②SO2通入B中,溶液颜色褪去,则该反应的离子方程式为_______________________。
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量_________(填字母),能产生白色沉淀。
A.氨水 B.稀盐酸 C.硝酸钾溶液 D.氯化钠溶液
(3)若从左端通入Cl2,写出Cl2与装置E中溶液反应的离子方程式____________________。
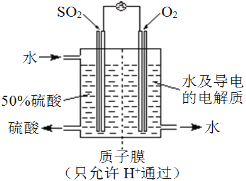
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图。含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2的电极为____极,其电极反应式为_____________________________;电池的总反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe 四种金属元素组成,回答下列问题:
(1)基态Fe原子有_______个未成对电子,Fe3+的价电子排布式为__________。
(2)新制的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙醛分子中含有的σ键与π键的比例为___。乙醛中碳原子的杂化轨道类型为_____,配合物[Cu(NH3)4](OH)2中含有的化学键类型有_________,1 mol该物质中有______个σ键。
(3)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。
(4)CaCl2熔点高于AlCl3的原因__________________________________。
(5)CaF2晶胞如图所示,已知:氟化钙晶体密度为ρg·cm-3,NA代表阿伏加德罗常数的值。氟化钙晶体中Ca2+和F-之间最近核间距(d)为______________pm(只要求列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计,约有80%~85%的化工生产过程使用催化剂,同样在化学实验室进行物质的制取时,也用到催化剂。以下反应不使用催化剂能顺利进行的是
A.实验室用过氧化氢制取氧气B.实验室制取氯气
C.工业上合成氨D.工业上制备硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com