
【题目】以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
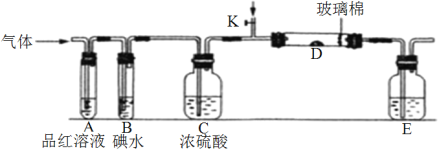
①若从左端分别通入SO2和Cl2,装置A中观察到的现象_________(填“相同或不相同”);若装置D中装的是V2O5(催化剂)。通入SO2时,打开K通入适量O2的化学反应方程式为__________________________________。
②SO2通入B中,溶液颜色褪去,则该反应的离子方程式为_______________________。
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量_________(填字母),能产生白色沉淀。
A.氨水 B.稀盐酸 C.硝酸钾溶液 D.氯化钠溶液
(3)若从左端通入Cl2,写出Cl2与装置E中溶液反应的离子方程式____________________。
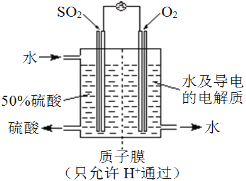
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图。含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2的电极为____极,其电极反应式为_____________________________;电池的总反应式为_______________________。
【答案】相同 2SO2+O2![]() 2SO3 SO2+I2+2H2O=4H++2I–+SO42– AC Cl2+2OH–=Cl–+ClO–+H2O 负 SO2-2e–+2H2O=SO42–+4H+ 2SO2+O2+2H2O=2H2SO4
2SO3 SO2+I2+2H2O=4H++2I–+SO42– AC Cl2+2OH–=Cl–+ClO–+H2O 负 SO2-2e–+2H2O=SO42–+4H+ 2SO2+O2+2H2O=2H2SO4
【解析】
根据物质的性质及实验原理分析实验现象并书写相关反应方程式;根据原电池原理及氧化还原原理判断正负极,书写离子方程式及电极反应式。
(1)①因为SO2和Cl2都可以使品红溶液褪色,所以装置A中观察到的现象相同;二氧化硫和氧气在催化剂作用下反应生成三氧化硫,方程式为:2SO2+O2![]() 2SO3;
2SO3;
② SO2具有还原性,可以还原碘水中的碘,反应的离子方程式为:SO2+I2+2H2O=4H++2I–+SO42–,
故答案为:相同;2SO2+O2![]() 2SO3;SO2+I2+2H2O=4H++2I–+SO42–;
2SO3;SO2+I2+2H2O=4H++2I–+SO42–;
(2)若加入的物质能和SO2反应生成硫酸或亚硫酸盐,则可以与氯化钡溶液反应产生白色沉淀,酸性溶液中硝酸根具有强氧化性,所以可以加入氨水和硝酸钾,
故答案为:AC;
(3)装置E为尾气处理装置,则离子方程式为:Cl2+2OH–=Cl–+ClO–+H2O,
故答案为:Cl2+2OH–=Cl–+ClO–+H2O;
(4)如图所示,二氧化硫反应后生成硫酸,硫元素化合价升高,失电子,作电池的负极;其电极反应式为SO2-2e–+2H2O=SO42–+4H+;总反应为二氧化硫、氧气和水反应生成硫酸,总反应式为2SO2+O2+2H2O=2H2SO4,
故答案为:负;SO2-2e–+2H2O=SO42–+4H+;2SO2+O2+2H2O=2H2SO4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中不正确的是 ( )
A. 沉淀中氢氧根的质量为(n-m)克
B. 恰好溶解后溶液中的NO3-离子的物质的量为![]() mol
mol
C. 生成标准状况下NO气体的体积为![]() L
L
D. 与合金反应反应的硝酸的物质的量为(![]() +
+![]() )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用硫铁矿烧渣(主要含 Fe2O3、SiO2 等)制备碱式硫酸铁[Fea(OH)b (SO4)c]溶液, 并测定其组成。

(1)酸浸时反应的化学方程式为___。
(2)操作 a 的名称为___,X 为___(填化学式)。
(3)加 CaCO3 调节溶液的 pH,其目的是中和溶液中的酸,并使 Fe2(SO4)3 转化为 Fea(OH)b (SO4)c。若溶 液的 pH 偏高,将会导致溶液中铁元素的含量降低,其原因是___(用文字表述)。
(4)为测定碱式硫酸铁的组成,取一定量样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的 BaCl2 溶液,得到白色沉淀 1.7475 g。另一份溶液,先将 Fe3+还原为 Fe2+,充分反应后向溶液中滴加 0.02000 mol·L-1 K2 Cr2O7溶液,完全反应时消耗K2 Cr2O7溶液 50.00 mL。求该样品的化学式(已知:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O)__________________。(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为短周期主族元素,其原子序数依次增大。A、B 两元素最高正价和最低负价之和为零。E和A同主族;D、F是地壳中含量最高的非金属元素和金属元素。
(1)写出C元素的元素名称_______,其在周期表中的位置__________________。E离子结构示意图为__________________;E2D2的电子式________________________。
(2)由A、C以原子个数比为5︰1组成的一种化合物,其中各原子均达到稳定结构,该化合物中所含化学键类型为_________________________。
(3)E2D2和A2D反应的离子方程式为__________________________________________。
(4)由C、E组成的一种离子化合物化学式为E3C,该化合物中两种离子的半径由大到小的顺序是____________(用元素符号表示);该化合物遇水剧烈反应,该反应的化学方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设C+CO2=2CO △H>0的反应速率为V1;N2+3H2=2NH3△H<0的反应速率为V2。若升温,V1和V2的变化可能是:
A.同时增大B.同时减少
C.V1增大、V2减少D.V1减少、V2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1)下列有关NH3的说法中,不正确的是__________(双选)。
A.工业合成NH3需要在高温高压下进行 B. NH3可用来生产碳铵和尿素等化肥
C. NH3可用浓硫酸或无水氯化钙干燥 D. NH3受热易分解,须置于冷暗处保存
(2)NH3易于水,标准状况下,用充满NH3的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为________________mol.L-1。
(3)氨气在氧化炉中所发生反应的化学方程式为_____________________________________________。
(4)“吸收塔” 尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为:Na2CO3+2NO2=NaNO3+________+CO2 (请填写完成化学方程式)。
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com