
【题目】将下列各组物质按单质、氧化物、酸、碱分类顺序排列,其中正确的是
A. 氧气、干冰、硫酸、烧碱 B. 碘酒、冰、盐酸、烧碱
C. 氢气、二氧化硫、硝酸、纯碱 D. 铜、硫酸钠、醋酸、石灰水
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
I.将 NaOH溶液与 NH4Cl 溶液混合生成 NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_________。
II.根据下图所示装置图回答以下问题。
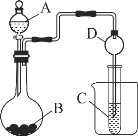
(1)实验室中现有药品Na2S、KMnO4、浓盐酸,某同学验证氯的非金属性大于硫,请写出试管中发的离子反应方程式______
(2)甲同学根据元素非金属性与对应最高价含氧酸之间关系,设计了如图装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;写出选用物质的名称:A__,B__,C___;上述反应的离子方程式_____;_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol·L-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示。下列说法不正确的是( )

A. HA为弱酸,BOH为弱碱
B. b点时,c(B+) = c(A-)
C. c点时,混合溶液呈碱性的主要原因是过量的BOH电离出OH-,使得溶液中c(OH-) > c(H+)
D. a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不合理的是
A. 用Na2S作沉淀剂除去污水中的Hg2+
B. 煤炭中加入CaCO3可以降低SO2对环境的污染
C. 工业用H2高温还原SiO2制粗硅
D. 可用Na2FeO4对自来水进行净化、杀菌和消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠又名大苏打、海波,可以用于治疗氰化物中毒等,某化学兴趣小组通过查阅资料,设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体并探究其性质。

已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l) ;S(s)+Na2SO3(aq) ![]() Na2S2O3(aq)
Na2S2O3(aq)
(1)装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以采取的措施有_________________________(写一条)
(2)常温下,用pH试纸测定0.1 mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是_______________________________。
(3)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气污染问题日益引起全民关注。
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm =103 nm)的颗粒物。下列说法不正确的是______(填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1 ~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)北京科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。

①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式依次为__________________、_________________。
②CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为_________。
③Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式_______________。
(3)工业上利用NO电解制备NH4NO3,其工作原理如下图所示,阳极的电极反应为________________,阴极的电极反应为__________________________,为使电解产物全部转化为NH4NO3,需补充物质A,A可以是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用硫铁矿烧渣(主要含 Fe2O3、SiO2 等)制备碱式硫酸铁[Fea(OH)b (SO4)c]溶液, 并测定其组成。

(1)酸浸时反应的化学方程式为___。
(2)操作 a 的名称为___,X 为___(填化学式)。
(3)加 CaCO3 调节溶液的 pH,其目的是中和溶液中的酸,并使 Fe2(SO4)3 转化为 Fea(OH)b (SO4)c。若溶 液的 pH 偏高,将会导致溶液中铁元素的含量降低,其原因是___(用文字表述)。
(4)为测定碱式硫酸铁的组成,取一定量样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的 BaCl2 溶液,得到白色沉淀 1.7475 g。另一份溶液,先将 Fe3+还原为 Fe2+,充分反应后向溶液中滴加 0.02000 mol·L-1 K2 Cr2O7溶液,完全反应时消耗K2 Cr2O7溶液 50.00 mL。求该样品的化学式(已知:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O)__________________。(请写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com