
【题目】下列各式中属于正确的水解方程式的是( )
A.Fe3+ + 3H2O![]() Fe(OH)3↓ + 3H+B.S2-+2H2O
Fe(OH)3↓ + 3H+B.S2-+2H2O![]() H2S + 2OH-
H2S + 2OH-
C.NH4+ + H2O![]() NH3·H2O + H+D.CH3COOH + H2O
NH3·H2O + H+D.CH3COOH + H2O![]() CH3COO- + H3O+
CH3COO- + H3O+
科目:高中化学 来源: 题型:
【题目】铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用___摄取铁元素的原子光谱。
(2)FeC13的熔点为306℃,沸点为315℃。由此可知FeC13属于____晶体。FeSO4常作净水剂和补铁剂,SO42-的立体构型是____。
(3)铁氰化钾 K3[Fe(CN)6]是检验Fe2+的重要试剂。
①基态N原子的轨道表示式为____。
②写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式_____。
③铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为____。
④铁氰化钾中,不存在___(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
(4)有机金属配位化合物二茂铁[(C5H5)2Fe]是汽油中的抗震剂。分子中的大Π键可用符号![]() 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为![]() ),则
),则![]() 中的大Π键应表示为____,其中碳原子的杂化方式为____。
中的大Π键应表示为____,其中碳原子的杂化方式为____。
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含__mol配位键。
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。其中铁原子周围最近的铁原子个数为___;六棱柱底边长为acm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为____g/cm3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为分析某有机化合物A的结构,进行了如下实验:
(1)向NaHCO3溶液中加入A,有气体放出,说明A中含有___________官能团(写结构简式)。
(2)向NaOH溶液中加入少许A,加热一段时间后,冷却,用HNO3酸化后再滴加AgNO3溶液,产生淡黄色沉淀,说明中A还有___________官能团(写名称)。
(3)经质谱分析,Mr(A)=153,且A中只有四种元素,则A的分子式为___________。
(4)核磁共振氢谱显示,A的氢谱有3种,其强度之比为1︰2︰2,则A结构简式为___________。
(5)已知A可发生如下图所示的转化:
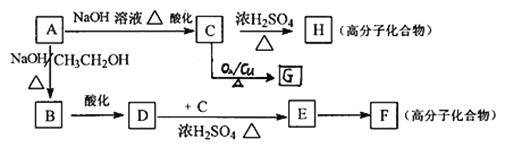
①A→B、D→E的反应类型分别为___________、___________。
②写出下列反应的化学方程式C→H:_________________________。
③C的同分异构体有多种,写出与C具有相同的官能团的C的同分异构体的结构简式:___________________________;写出F的结构简式:________________________。
④G与过量的银氨溶液反应,每生成2.16gAg,消耗G的物质的量是__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二元酸H2X易溶于水
(1)常温下,向0.1mol/L的酸式盐NaHX的溶液中滴入几滴紫色石蕊试液,溶液变成红色。
①若测得此溶液的pH=1,则NaHX溶于水时的电离方程式为__________
②若NaHX溶液中能检测到H2X分子,则溶液中c(X2-)__________(填>、<或=)c(H2X),c(X2-)+c(HX-)+c(H2X)=__________mol/L
(2)常温下,0.1mol/LNaHX溶液中存在的离子有Na+、X2-、HX-、H+、OH-,存在的分子只有H2O,且c(H+)=0.01mol/L
①该溶液中c(HX-)+c(X2-)=__________mol/L
②常温下,0.1mol/LH2X溶液中c(H+)________(填>、<或=)0.11mol/L
(3)若NaHX溶液中检测不到H2X分子但可检测到HX-,则溶液中c(H+)-c(OH-)________(填>、<或=)c(X2-),若HX-的电离平衡常数K=2.5×10-6,则0.4mol/L的NaHX溶液的pH约为__________
(4)常温下向20mL 0.05mol/L某稀酸H2X溶液中滴入0.1mol/L氨水,溶液中由水电离出来的氢离子浓度随滴入氨水体积变化如图,下列分析正确的是________(填字母代号)
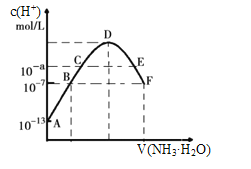
A.NaHX溶液可能为酸性,也可能为碱性
B.A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C.E点溶液中离子浓度大小关系:c(NH4+)>c(X2-)>c(OH-)>c(H+)
D.F点溶液:c(NH4+)=2c(X2-)
(5)已知某混合溶液中含有4molNa2X、2molNa2CO3和1molNaHCO3。往溶液中通入4molCO2气体,充分反应后气体全部被吸收,反应后Na2CO3和NaHCO3的物质的量分别为________,________(不考虑弱酸根离子的电离及水解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
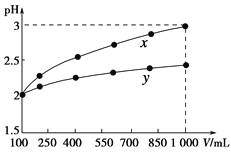
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl—)与c(SO42—)之比为( )

A. 1∶1 B. 2∶3 C. 3∶2 D. 2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃,将amolN2和bmolO2充入体积为IL的密闭容器中发生反应: N2(g)+O2(g)=2NO(g)△H=181.5kJ/mol,反应过程中v正与v逆的变化如图所示。下列说法正确的是

A.若t1时NO为cmol,则0~t1时间段内平均反应速率v(N2)=
B.t1~t2时间段内v正(O2)=2v逆(NO)
C.图中所示的阴影部分面积的含义是v正与v逆的差
D.其他条件不变,t2时刻升高温度,v正与v逆均增大,且v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用亚硫酸钠固体和70%的浓硫酸制备SO2气体,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,请设计一套实验装置,收集一试管干燥的SO2气体。
(1)在下面方框中,A表示由分液漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必画出,尾气处理部分必须画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C…;其它可选用的仪器(数量不限)简易表示如下:___

(2)根据方框中的装置图甲,在答题卡上填写下表(可不填满)___
仪器标号 | 仪器中所加物质 | 作用 |
A | 亚硫酸钠、浓硫酸 | 产生SO2 |
(3)某实验小组用如图乙装置测定收集到的气体中SO2的含量,反应管中装有酸性高猛酸钾溶液。
①SO2和酸性高猛酸钾溶液发生反应的离子方程式为:___。
②反应管内溶液紫红色消失后,若没有及时停止通气,则测得的SO2含量___(选填:“偏高”、“偏低”或“无影响”)
③若酸性高猛酸钾溶液体积为V1mL,浓度为cmol/L,量气管内增加的水的体积为V2mL(已折算成标准状况下的体积)。用c、V1、V2表示SO2的体积百分含量为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com