
【题目】在透明溶液中,下列各组离子能大量共存的是
A. HCO3-、ClO-、K+、H+ B. Na+、Fe2+、NO3-、H+
C. K+、Cu2+、Cl-、SO42- D. OH-、NH4+、Cl-、SO32-
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32、SO42、NO3中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
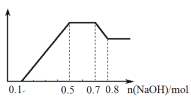
A.溶液中一定不含CO32,可能含有SO42和NO3
B.溶液中n(NH4+)=0.2mol
C.溶液中的阳离子只有H+、Mg2+、Al3+
D.n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X,Y,Z,E,F五种常见物质含有同一元素M,在一定条件下它们有如图转化关系,Z是NO,下列推断不合理的是( ) 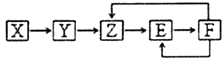
A.X可能是一种氢化物
B.X生成Z一定是化合反应
C.E可能是一种有色气体
D.F中M元素的化合价可能为+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)写出表示含有8个质子,10个中子的原子的化学符号: .
(2)根据下列微粒回答问题: ![]() H,
H, ![]() H,
H, ![]() H,14C,14N,16O,35Cl2、37Cl2 .
H,14C,14N,16O,35Cl2、37Cl2 .
①以上8种微粒共有种核素,共种元素.
②互为同位素的是 .
③质量数相等的是和 , 中子数相等的是和 .
(3)相同物质的量的14CO2与S18O2的质量之比为;中子数之比为;电子数之比为 .
(4)铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是: . (铷的相对原子量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当A,B的物质的量之比为1:4且A为黑色固体时,该反应的离子方程式是;
②当A,B的物质的量之比为1:6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移: .
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示) .
(2)若A为单质,B为无色油状黏稠液体,当 A,B的物质的量之比为1:2时,则A可能为 , 检查其中刺激性气体产物X的方法是 .
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1:4反应.
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为 .
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1:2时,则被还原的X是mol.
(4)若A,B,X,Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 .
(5)若A,B,X,Y均为化合物.X为极易溶于水的气体,则盐A是盐,生成气体X的离子方程式为 , 检验该气体的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验SO2中是否混有CO2气体,可采用的方法是
A. 通过品红溶液,若品红溶液褪色,则说明混有CO2气体
B. 通过澄清石灰水,若变混浊,则说明混有CO2气体
C. 先通过足量NaOH溶液,再通过澄清石灰水,若变混浊,则说明混有CO2气体
D. 先通过足量KMnO4溶液,再通过澄清石灰水,若变混浊说明混有CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:

已知:
![]()
(1)A属于芳香烃,其名称是___________________。
(2)B的结构简式是____________________________。
(3)由C生成D的化学方程式是___________________________________________。
(4)由E与I2在一定条件下反应生成F的化学方程式是____________________________;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是_____________________________________。
(5)试剂b是_____________________________。
(6)下列说法正确的是___________(选填字母序号)。
a. G存在顺反异构体
b. 由G生成H的反应是加成反应
c. 1 mol G最多可以与1 mol H2发生加成反应
d. 1 mol F或1 mol H与足量NaOH溶液反应,均消耗2 molNaOH
(7)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成,写出合成 的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______。
的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g)ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
2NO2(g)ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是

A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a深、c浅
C.a、b两点气体的平均相对分子质量:a>b
D.b、c两点化学平衡常数:b<c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com