
【题目】硫酸是当今世界上最重要的化工产品之一,硫酸在生产中具有广泛的应用。
(1)某同学用如图所示的装置,完成铜与浓硫酸反应的实验:

①试管II中的现象是___。
②试管Ⅰ中发生反应的化学方程式是___。
③请你指出该实验装置的不足之处___。
(2)在实际应用中,人们常根据需要,把浓硫酸稀释成不同浓度的稀硫酸。现用18.4mol·L-1的浓H2SO4配制100mL1.00mol·L-1的稀H2SO4。
①用量筒量取浓硫酸的体积是___mL。
②下列操作会使所配溶液浓度偏低的是___。
A.将溶液转移到未干燥的容量瓶中
B.转移时,忘记洗涤烧杯和玻璃棒
C.将未冷却的溶液转移到容量瓶中
D.定容时,仰视刻度线
【答案】品红溶液褪色(或颜色变浅) Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 缺少尾气吸收装置,多余的二氧化硫会污染环境 5.4 B、D
CuSO4+SO2↑+2H2O 缺少尾气吸收装置,多余的二氧化硫会污染环境 5.4 B、D
【解析】
(1)在加热的条件下,浓硫酸和铜反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑,SO2具有漂泊性,使品红溶液褪色,但SO2是大气污染物,缺少尾气吸收装置;
CuSO4+2H2O+SO2↑,SO2具有漂泊性,使品红溶液褪色,但SO2是大气污染物,缺少尾气吸收装置;
(2)①依据配制过程中硫酸的物质的量不变,根据V=![]() 计算出需要浓硫酸的体积;
计算出需要浓硫酸的体积;
②分析操作对溶质物质的量和溶液体积的影响,依据c=![]() 进行误差分析。
进行误差分析。
(1)①在加热的条件下,浓硫酸和铜反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑,SO2具有漂泊性,所以试管Ⅱ中的现象是品红溶液褪色(或颜色变浅);
CuSO4+2H2O+SO2↑,SO2具有漂泊性,所以试管Ⅱ中的现象是品红溶液褪色(或颜色变浅);
②在加热的条件下,浓硫酸和铜反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;
③SO2是大气污染物,所以实验装置的不足之处是缺少尾气吸收装置,多余的二氧化硫会污染环境;
(2)①配制过程中硫酸的物质的量不变,则V=![]() =
=![]() =5.4mL;
=5.4mL;
②A.将溶液转移到未干燥的容量瓶中,不影响溶液浓度,故A不符合题意;
B.转移时,忘记洗涤烧杯和玻璃棒,导致部分溶质损坏,溶质物质的量偏小,溶液浓度偏低,故B符合题意;
C.将未冷却的溶液转移到容量瓶中,冷却后溶液体积偏小,溶液浓度偏高,故C不符合题意;
D.定容时,仰视刻度线,导致溶液体积偏大,溶液浓度偏小,故D符合题意;
答案选B、D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A. Y的分子式为C10H8O3
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能发生加聚反应和缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:

(1)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是______________________________;滤渣可循环利用,滤渣的主要成分是____________(填化学式)。
(2)该工艺需控制NO和NO2物质的量之比接近1∶1。
若排放的尾气中NO含量升高,则NO和NO2物质的量之比______;若产品Ca(NO2)2中Ca(NO3)3含量升高,则NO和NO2物质的量之比_______。(填写序号)
①=1∶1 ②>1∶1 ③<1∶1 ④无法判断
(3)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,据此信息,某同学所写的反应离子方程式为2NO2-+2H+=NO2+NO↑+H2O,你同意吗?_________(填“同意”或“不同意“),如不同意,请说明你的理由________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时用0.10mol/L的KOH溶液滴定20.00mL0.10 mol/L的H2C2O4溶液,滴定过程中溶液的pH随KOH溶液体积变化如图所示(忽略滴定过程中溶液的温度变化和体积变化),下列说法错误的是( )
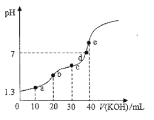
A. 25℃时H2C2O4的电离常数Ka1=10-1.6
B. b点满足关系:c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-)
C. c点溶液中粒子浓度大小顺序:c(K+)>c(C2O42-)>c(HC2O4)>c(H2C2O4)
D. 从a点到e点水的电离程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 一定条件下反应N2+3H2![]() 2NH3,达到平衡时,3v正(H2)=2v正(NH3)
2NH3,达到平衡时,3v正(H2)=2v正(NH3)
B. 25℃时,0.1 mol/L的NaHB溶液呈酸性,说明H2B为强酸
C. 将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3H2O)变小
D. 10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是

A. d点所示溶液中:c(NH4+)═2c(SO42)
B. C点所示溶液中:c(H+)c(OH)═2c(NH3·H2O)
C. NH3·H2O的电离常数K=104
D. V=40
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向密闭容器中充入一定量的NO2和SO2,发生反应:NO2+SO2![]() NO+SO3,当化学反应达到平衡时,下列叙述正确的是( )。
NO+SO3,当化学反应达到平衡时,下列叙述正确的是( )。
A.SO2和SO3的物质的量一定相等
B.NO2和SO3的物质的量一定相等
C.反应混合物的总物质的量一定等于反应开始时NO2和SO2的总物质的量
D.SO2、NO2、NO、SO3的物质的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用电子式表示H2O和MgBr2的形成过程:
H2O__;MgBr2__;
(2)写出CO2、Na2O2、H2O2的电子式:
CO2_;Na2O2__;H2O2___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com