
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取Al可采用如图所示工艺流程:
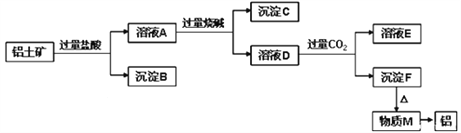
请回答下列问题:
(1)铝土矿加入盐酸后生成Al3+的离子方程式为_____________________________。
(2)沉淀B与烧碱反应的离子方程式为______________________________________。
(3)溶液D中通入过量CO2的离子方程式为_____________________________。
(4)“通入过量CO2”能否改用过量盐酸________(填“能或否”),原因是_____________。
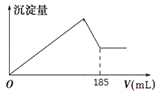
(5)向共含有0.05mol Al3+、Fe3+的溶液中滴入1mol/L NaOH 溶液,生成沉淀的量与加入NaOH 溶液的体积关系如图所示。 则溶液中Al3+的物质的量为_________mol。
【答案】 Al2O3+6H+=Al3++3H2O SiO2+2OH-=SiO32-+H2O AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- CO2+OH-=HCO3- 否 Al(OH)3会溶解在盐酸中 0.035
【解析】Al2O3、SiO2、Fe2O3、MgO中,Al2O3、SiO2与NaOH溶液反应,MgO、Fe2O3不与NaOH溶液反应;除SiO2不与盐酸反应外,Al2O3、Fe2O3、MgO均与盐酸反应;加入过量盐酸,溶液A为AlCl3、MgCl2、FeCl3,沉淀B为SiO2,加入过量烧碱,沉淀C为Fe(OH)3和Mg(OH)2,溶液D为NaAlO2,通入过量二氧化碳,溶液E为NaHCO3,沉淀F为Al(OH)3,加热分解得到M为Al2O3,经电解可得到Al,则
(1)加入盐酸后生成Al3+的离子方程式为Al2O3+6H+=Al3++3H2O;(2)B为二氧化硅,与氢氧化钠反应生成硅酸钠,反应的离子方程式为SiO2+2OH-=SiO32-+H2O;(3)D含有NaAlO2,通入过量二氧化碳反应生成氢氧化铝沉淀,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;(4)因氢氧化铝溶于盐酸,所以不能用盐酸代替二氧化碳;(5)由图象可知氢氧化铝完全沉淀时消耗185mL氢氧化钠,即消耗0.185molNaOH,设含有xmolAl3+,ymolFe3+,涉及离子方程式为Fe3++3OH-= Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,则x+y=0.05、4x+3y=0.185,解得x=0.035。


科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)n(B)的变化关系.则下列结论正确的是( ) 
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04molL﹣1min﹣1
B.图Ⅱ所知反应xA(g)+yB(g)zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是
A.用蒸馏的方法分离汽油和煤油
B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.浓硫酸稀释时,应将浓硫酸慢慢加到水中,及时搅拌并冷却
D.将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是

A.a点对应的溶液中:Na+、AlO2-、SO42-、NO3-
B.b点对应的溶液中:Ba2+、K+、NO3-、Cl-
C.c点对应的溶液中:Na+、Ag+、Mg2+、NO3-
D.d点对应的溶液中:Cl-、NO3-、Fe2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,利用CO2合成CH3OH的反应如下: CO2(g)+3H2(g)H3OH(g)+H2O(g)△H1 ,
研究发现,反应过程中会有副反应:
CO2(g)+H2(g)CO(g)+H2O(g)△H2 .
温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )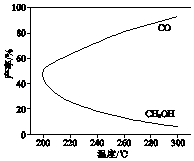
A.△H1<0,△H2>0
B.增大压强有利于加快合成反应的速率
C.生产过程中,温度越高越有利于提高CH3OH的产率
D.合成CH3OH反应的平衡常数表达式是K= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“铁及其化合物”有关性质的实验探究,并共同解答下列问题:
探究一 设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。

(1)硬质玻璃管B中发生反应的化学方程式为_______________________________。
(2)反应前A中投放碎瓷片的目的是____________________。
(3)装置E中的现象是__________________________________。
探究二 FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需的玻璃仪器是________。
(2)下列有关配制过程中说法正确的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
实验步骤、预期现象 | 结论 |
①向溶液中加入__________,振荡、静置, 现象:下层呈橙红色,上层呈无色 | 假设1正确 |
②向溶液中加入_____________ 现象:溶液变为红色 | 假设2正确 |
若假设1正确,从实验①中分离出Br2的实验操作名称是_______________ 。
(4)已知:Br2+2Fe2+=2Fe3++2Br-。若在50mL上述FeBr2溶液中通入标准状况112mlCl2,反应的离子方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是
A.酸:HNO3、H2SO4、NaHSO4、HClB.碱性氧化物:CuO、Na2O、CaO、MgO
C.胶体:牛奶、豆浆、碘酒、氢氧化铝D.电解质:KCl、Na2CO3、C2H5OH、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪种物质所含原子数与0.2mol H3PO4所含原子数相等
A.0.4mol H2OB.0.2mol H2SO4C.0.8mol HClD.0.3mol HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图电解装置中,电极A是由金属M制成的,B、C和D都是铂电极,甲中的电解质溶液为MSO4 , 乙中的电解质为H2SO4 . E、F是外接直流电源的两极,电路接通后,电极B上有金属M析出.(已知金属M无变价) 
(1)电池中E是极,F是极.
(2)A极上电极反应为 , B极上电极反应为 , C极上电极反应为 , D极上电极反应为 .
(3)当电路中通过2.408×1022个电子时停止电解,发现B极上析出1.27gM,则金属M的相对原子质量为 .
(4)如果再将外接直流电源的正负极交换接入原电路,当通过1mol电子后,B极的电极反应为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com