
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
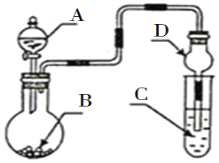
A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀,然后沉淀又溶解
C.实验仪器D可以起到防止溶液倒吸的作用
D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
【答案】C
【解析】
A. 若A为浓盐酸,B为KMnO4晶体,二者反应生成氯气,把氯气通到紫色石蕊溶液中,氯气与水反应生成HCl和HClO,HCl具有酸性,使紫色石蕊溶液变红,HClO具有漂白性,使溶液褪色,C中溶液最终呈无色,A错误;
B. 若A为浓氨水,B为生石灰,滴入后反应生成氨气,氨气和铝离子反应生成氢氧化铝,但氢氧化铝不溶于弱碱一水合氨,所以C中产生白色沉淀不溶解,B错误;
C. D中球形干燥管中间部分较粗,盛放液体的量较多,倒吸的液体靠自身重量回落,因此可以防止液体倒吸, C正确;
D.若A为浓硫酸,B为Cu,反应需要加热才能发生,如果不加热,则没有二氧化硫产生,所以C中溶液无变化,D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】绿色化学要求利用化学反应原理从源头上消除污染。以铜为原料制备硫酸铜,下列四种原理设计,其中最能体现“绿色化学”要求的是( )
A.Cu +2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
B.Cu +Cl2![]() CuCl2,CuCl2+ H2SO4(浓)
CuCl2,CuCl2+ H2SO4(浓)![]() CuSO4+2HCl↑
CuSO4+2HCl↑
C.Cu + H2SO4+H2O2![]() CuSO4+2H2O
CuSO4+2H2O
D.3Cu +8HNO3=3Cu(NO3)2+2NO↑+4H2O,Cu(NO3)2+H2SO4(浓)![]() CuSO4+2HNO3↑
CuSO4+2HNO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A.向水中加入NaHSO4固体,平衡逆向移动,c(H+)降低
B.将水加热,Kw增大,pH不变
C.向水中加入固体醋酸钠,平衡逆向移动,c(H+)降低
D.向水中加入固体氢氧化钠,平衡逆向移动,c(OH-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某体积固定的密闭容器中加入2 mol A和1 mol B,发生可逆反应![]() ,下列说法正确的是
,下列说法正确的是
A. 当容器内压强不变时说明反应已达到平衡
B. 当反应达到平衡时:c(A):c(B):c(C)=2:1:3
C. 当反应达到平衡时放出热量akJ
D. 其他条件不变,升高温度反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中存在广泛用途。
(1)基态铁原子电子排布式为___,自然界中存在的54Fe和56Fe,它们互称为__。
(2)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是___。通常证明某溶液中含Fe3+的实验步骤是__。
(3)SO2有强还原性,写出其与FeCl3溶液反应的离子方程式___。若有0.4molFeCl3发生反应,则需要标准状况下的SO2__升。
(4)发黄的深井水通常含Fe3+,若向水中加入Na2CO3溶液,则产生红褐色沉淀和无色无味的气体。写出相应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。
(1)+6价的Cr能引起细胞的突变而对人体不利,可用亚硫酸钠将其还原。离子反应方程式为:3SO32-+Cr2O72-+8H+===2Cr3++3SO42-+4H2O,该反应氧化剂和还原剂的物质的量之比为___________。
(2)工业上利用铬铁矿( FeO. Cr2O3)冶炼铬的工艺流程如图所示:
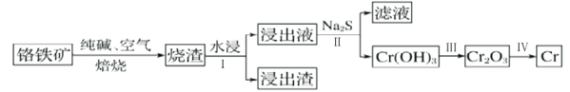
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②水浸Ⅰ要获得浸出液的操作是___________。
③浸出液的主要成分为Na2CrO4,加入Na2S反应后有Na2SO4生成,则操作Ⅱ发生反应的离子方程式为___________。
(3)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀pH为___________[c(Cr3+)降至10-5mol·L-1可认为完全沉淀]。
(4)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=Cr2O72-+H2O)。
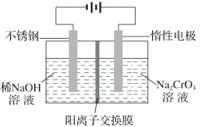
①阳极的电极反应式为___________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则生成重铬酸钠的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在人类生活、生产中发挥着重要的作用。
(1)下列物质中不属于合金的是 ____________。
A.钢 B.青铜 C.黄铜 D.水银
(2)在钠、铝、铁三种金属元素中,金属活动性最强的是______ ,所形成的氧化物中适宜做耐火材料的是_______。向盛有硫酸铝溶液的试管中滴加氨水,反应的离子方程式为____________ 。
(3)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用如图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是_________。反应开始时,打开止水夹的目的是____________;一段时间后,关闭止水夹,在试管_______(填“A”或“B”)中观察到白色的Fe(OH)2
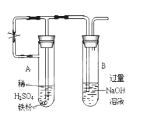
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是______ 。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬酸铅![]() 用作油性合成树脂涂料、印刷油墨、水彩和油彩的颜料,色纸、橡胶和塑料制品的着色剂。
用作油性合成树脂涂料、印刷油墨、水彩和油彩的颜料,色纸、橡胶和塑料制品的着色剂。
(1)![]() 中Cr的化合价为________________。
中Cr的化合价为________________。
(2)铬酸铅用于水彩和油彩的筑色颜料。遇到空气中的硫化物颜色会变黑:![]() 的平衡常数
的平衡常数![]() ________________。
________________。![]()
(3)铬渣![]() 铬主要以
铬主要以![]() 形式存在,同时含有
形式存在,同时含有![]() 、
、![]() 等杂质
等杂质![]() 是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬的环境污染。铬渣综合利用工艺流程如下:
是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬的环境污染。铬渣综合利用工艺流程如下:
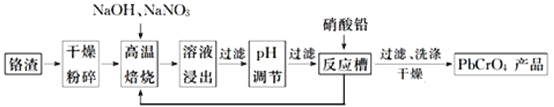
请回答下列问题:
![]() 铬渣高温焙烧前粉碎的目的是_____________________________。
铬渣高温焙烧前粉碎的目的是_____________________________。
![]() 高温焙烧得到的产物含有
高温焙烧得到的产物含有![]() 和一种无污染的气体,则氧化剂和还原剂物质的量之比为________________。
和一种无污染的气体,则氧化剂和还原剂物质的量之比为________________。
![]() 高温焙烧时
高温焙烧时![]() 参加反应的化学方程式为________________________。
参加反应的化学方程式为________________________。
![]() 除去浸出液中的杂质最好加入________
除去浸出液中的杂质最好加入________![]() 填试剂名称
填试剂名称![]() 来调节pH。除去铝元素的离子方程式为___________________________________________。
来调节pH。除去铝元素的离子方程式为___________________________________________。
![]() 现通过以上流程处理
现通过以上流程处理![]() 的铬渣,得到
的铬渣,得到![]() 产品
产品![]() ,则铬渣中
,则铬渣中![]() 的质量分数是________
的质量分数是________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠(Na2MoO4)是一种新型阻燃剂和水处理剂。从一种含钼的废弃催化剂(主要成分为MoO3、Al2O3、Fe2O3等)中可回收Na2MoO4,其工艺流程如下:
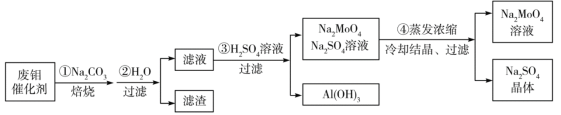
已知:MoO3,Al2O3与SiO2相似,均能在高温下与Na2CO3发生类似反应。
下列有关叙述错误的是
A.焙烧时发生反应之一:Al2O3+Na2CO3=2NaAlO2+CO2↑
B.用硫酸浸取②操作后所得滤渣并加入KSCN,溶液变为血红色
C.步骤③中可以用CO2代替硫酸
D.步骤④中可知Na2MoO4溶解度随温度变化较小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com