
����Ŀ����֪25�桢101 kPaʱijЩ���ʵ�ȼ�����������£�
���� | ��ѧʽ | ��H (kJ/mol) | ���� | ��ѧʽ | ��H (kJ/mol) |
ʯī | C(s) | 393.5 | ���� | C2H6(g) | 1560 |
���ʯ | C(s) | 395.0 | ��ϩ | C2H4(g) | 1411 |
���� | H2(g) | 285.8 | ��Ȳ | C2H2(g) | 1300 |
һ����̼ | CO(g) | 283.0 | �Ҵ� | C2H5OH(l) | 1367 |
��1����ͬ�����������������ʣ���ȫȼ�շ�������������____��
��2��ʯī����ʯ��Ϊ____��
a.ͬλ�� b.ͬ�������� c.ͬ���칹�� d.ͬϵ��
���³�ѹ�£����߸��ȶ�����___�������������ƣ�
��3���ڱ�״���£�22.4LCO��C2H2�Ļ�������ڹ�������������ȫȼ�շų�1096.6 kJ���ȣ���ȼ�ղ�����CO2�����ʵ���Ϊ___mol��
��4��������Ni������ʱ����ϩ�����������ӳɷ�Ӧ���ʱ䡣C2H4(g)+H2(g)=C2H6(g) ��H=____��
��5����֪�ƻ����л�ѧ����Ҫ���յ��������£�
C��C | C=C | H��H |
347kJ/mol | 619kJ/mol | 436kJ/mol |
���ݣ�4���Ľ��ۣ�����C��H���ļ���Ϊ____kJ/mol��
a��322.5 b��422.5 c.522.5 d��622.5
���𰸡����� b ʯī 1.8 ��137kJ/mol b
��������
��1����ͬ�����Ŀ�ȼ���Է�������ԽС�����ʵ���Խ�࣬�ٽ�Ϸ�Ӧ�ȱȽϷų���������С��
��2��ʯī����ʯ��ͬ��Ԫ����ɵIJ�ͬ���ʣ�����Խ��Խ�ȶ���
��3����CO�����ʵ���Ϊx mol��������������з�������μӷ�Ӧ��CO��C2H2���Ե����ʵ�����������Ԫ���غ��ҳ����ɵĶ�����̼�����ʵ�����
��4�����ݸ�˹���ɹ�����֪�Ȼ�ѧ����ʽ���ҳ���Ӧ��֮��Ĺ�ϵ��
��5����Ӧ��=��Ӧ��ϼ������յ�����-������ɼ����ų���������
��1����ϱ������ݱȽ���ͬ�����������������ʣ����������ʵ��������ȫȼ�շ�����࣬�ʴ�Ϊ��������
��2��ʯī����ʯ��Ϊͬ�������壻ʯī�Ƚ��ʯ�������ͣ�ʯī���ȶ����ʴ�Ϊ��b��ʯī��
��3���ڱ�״���£�22.4L CO��C2H2�Ļ����������ʵ���Ϊ![]() =1 mol����CO�����ʵ���Ϊx mol������������������ݿ�֪��283.0 kJ/mol
=1 mol����CO�����ʵ���Ϊx mol������������������ݿ�֪��283.0 kJ/mol![]() x mol+1300 kJ/mol
x mol+1300 kJ/mol![]() (1-x)mol=1096.6 kJ�����x=0.2 mol����CO�����ʵ���Ϊ0.2 mol��C2H2�����ʵ���Ϊ��1-0.2��mol=0.8 mol�����ɶ�����̼�����ʵ���Ϊ0.2mol+0.8mol
(1-x)mol=1096.6 kJ�����x=0.2 mol����CO�����ʵ���Ϊ0.2 mol��C2H2�����ʵ���Ϊ��1-0.2��mol=0.8 mol�����ɶ�����̼�����ʵ���Ϊ0.2mol+0.8mol![]() 2=1.8 mol���ʴ�Ϊ��1.8��
2=1.8 mol���ʴ�Ϊ��1.8��
��4�����ݱ�����Ϣ��֪����ϩ��ȼ����Ϊ1411 kJ/mol�����Ȼ�ѧ����ʽΪ��C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ![]() = 1411 kJ/mol�٣�ͬ������������ȼ���Ⱥ������ȼ���ȿ�֪�ã�H2(g)+
= 1411 kJ/mol�٣�ͬ������������ȼ���Ⱥ������ȼ���ȿ�֪�ã�H2(g)+![]() O2(g)= H2O(l)
O2(g)= H2O(l) ![]() = 285.8 kJ/mol�ڣ�C2H6(g)+
= 285.8 kJ/mol�ڣ�C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l)
O2(g)=2CO2(g)+3H2O(l) ![]() = 1560 kJ/mol�ۣ����+��-�۵�C2H4(g)+H2(g)=C2H6(g) ��H=1411 kJ/mol285.8 kJ/mol-��1560 kJ/mol��
= 1560 kJ/mol�ۣ����+��-�۵�C2H4(g)+H2(g)=C2H6(g) ��H=1411 kJ/mol285.8 kJ/mol-��1560 kJ/mol��![]() ��137kJ/mol���ʴ�Ϊ����137kJ/mol��
��137kJ/mol���ʴ�Ϊ����137kJ/mol��
��4����C��H���ļ���Ϊx kJ/mol�����ݱ������ݿɵã�619 kJ/mol+4x kJ/mol+436kJ/mol-(347kJ/mol+6x kJ/mol)= ��137kJ/mol�����x=422.5��b����ȷ���ʴ�Ϊ��b��


 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Ga)����ͬ���壬������Ϊ����������������������������Ϊ���Ի������ҵ�Ʊ��ص���������ͼ��ʾ��
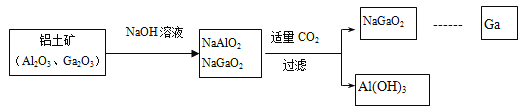
�����жϲ��������ǣ�
A. Al��Ga������IIIA��
B. Ga2O3�������ᷴӦ����GaCl3
C. Ga(OH)3����NaOH��Ӧ����NaGaO2
D. ���ԣ�Al(OH)3>Ga(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ṹ��ʽ��ͼ��ʾ���л��ﳣ���ںϳ�ҩ����жԸ��л���˵������ȷ����
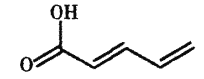
A.����˳���칹��
B.���ϩ�ụΪͬϵ��
C.�����ֹ�����
D.��H2�������ʵ�����ϵ��Ӧʱ��������3�ּӳɲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ��Ѥ������ɫ�仯����չ���˻�ѧ�����棬�����˻�ѧ֮�������б仯�е�a��b��c��d�����ǻ����������������߷�Ӧ���͵�����һ����ȷ����
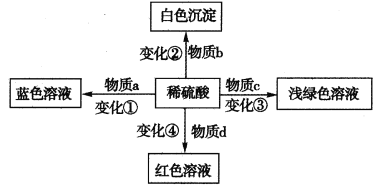
A.�仯��һ��������������ԭ��Ӧ
B.�仯�ڵõ��İ�ɫ����һ����������
C.����c��һ�����ܺ�����������������
D.����d������ij�л����ˮ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ����20.00 mL 0.10 mol/LCH3COOH��Һ�е���0.10 mol/LNaOH��Һ����ҺpH��NaOH��Һ����Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
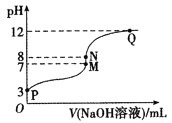
A.T��ʱ��CH3COOH�ĵ���ƽ�ⳣ��Ka=1.0��10-3
B.M���Ӧ��NaOH��Һ�����Ϊ20.00 mL
C.N����ʾ��Һ��c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.N����Q����ʾ��Һ��ˮ�ĵ���̶ȣ�N>Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�����з������ʱ仯��ͬʱ���������������ı仯�����������ı仯������������ʽ���ֳ�����������Ӧ�ȡ����ڷ�Ӧ�������ͬ����Ӧ�ȿɷ�Ϊ�����֣���ȼ���Ⱥ��к��ȵȡ�
��1��10g����ȼ��������̬ˮ���ų�1209kJ��������H2O(1)=H2O(g) ��H��+44kJ/mol��д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��______��
��2������50mL0.25molL-1���ᡢ50mL 0.55molL-1NaOH��Һ������ͼ��ʾװ���вⶨ�к��ȣ��ش��������⣺
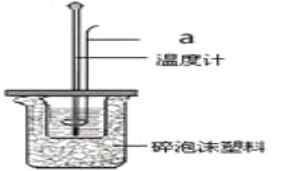
������a��������_____��
��ʹ��������Ʒ����Ϊ�˼�Сʵ��������______��
A��������Ͳ B������a C����ĭ���ϰ� D������ĭ����
����װ�������С�ձ��е���NaOH��Һ����ȷ������____��
A���ز������������� B���������������� C��һ����Ѹ�ٵ���
�ܼ������������������Һ���ܶȶ���1gcm-3����֪�кͷ�Ӧ��������Һ�ı�����c=4.18Jg-1��-1����t=3.4�棬��ʵ���õ��к�����ֵΪ____��������һλС����
�����в�������ʹ�������к�����ֵ�ı����___��
A�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�Ӳⶨ������¶�
B������ճ�����ʵ�ʸ�ʵ���ڱ��±��н���
C���� 0.275molL-1Ba��OH��2��Һ��������������Һ
D��������a��Ϊͭ��Ʒ
E����60mL 0.5molL-1������50mL 0.55molL-1 NaOH��Һ��Ӧ
F����0.5molL-1�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������п����Ҫ�ɷ�ΪZnS��������CdS��Fe2O3�����ʣ�Ϊԭ������ZnSO4��7H2O�Ĺ����������£�����֪Cd�Ľ�����Խ���Zn��Fe֮�䣩
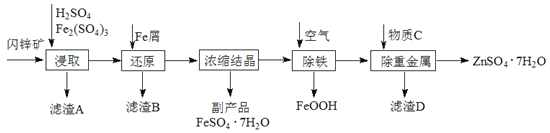
��1��������A�пɻ��һ�ֵ���ɫ�ǽ������ʵĸ���Ʒ���仯ѧʽΪ________��
��2����ȡ������Fe2(SO4)3��������_______________����ȡʱFe2(SO4)3��ZnS������Ӧ�Ļ�ѧ����ʽΪ____________________________________________��
��3���������̿�����Һ��pH��5.4���ң��÷�Ӧ�����ӷ���ʽΪ_______________________���ù����ڿ�����ڴ������һ��������ԡ��ͷ��װ�ã���Ŀ����____________________________________��
��4���û������ؽ���������Cd2+����������CΪ_________��
��5������п���ܽ�����¶�֮��Ĺ�ϵ���±���
�¶�/�� | 0 | 20 | 40 | 60 | 80 | 100 |
�ܽ��/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
�ӳ��ؽ����������п��Һ�л������п�����ʵ�����Ϊ__________��__________�����ˡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�������������������������һ�������¾��ܷ�����Ӧ����
| �� | �� | �� |
A | Al | HCl | NaOH |
B | NH3 | O2 | HNO3 |
C | SiO2 | NaOH | HF |
D | SO2 | Ca(OH)2 | NaHCO3 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ,����������ȷ����
A.28g��ϩ�ͱ�ϩ�еļ��Լ���ĿΪ4NA
B.1.0molCH4��Cl2�ڹ����·�Ӧ����CH3Cl������Ϊ1.0NA
C.1mol�����к��е�ԭ������Ϊ2NA
D.0.1L0.1molL-1MgCl2��Һ�е�Mg2+��ĿΪ0.01NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com