
【题目】某反应的氧化剂与还原剂及部分产物如下所示:2Mn2+ + 5IO4— + …… → 2MnO4— + ……已知该反应体系还包括H+、H2O与另一种含碘微粒。对于该氧化还原反应说法正确的是
A.Mn2+是氧化剂,IO4—是还原剂
B.体系中另一种含碘微粒为I—
C.随着反应进行,溶液pH不断上升
D.每有1 mol IO4—参加反应,转移2 mol电子
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】镁铝合金具有良好的强度、刚性、优良的电磁屏蔽性和导热性,使之成为笔记本电脑和轻薄手机的首选外壳材料。为测定某手机外壳镁铝合金中镁和铝的含最,并回收镁铝,某实验小组设计如下实验方案。
①除去手机外壳的涂层,剪其中一小块,称取其质量;
②组装仪器,检查气密性,用足盘稀盐酸溶解合金;
③测量产生气体的体积,计算结果;
④利用下列流程,从溶解合金后的溶液中回收分离镁铝。
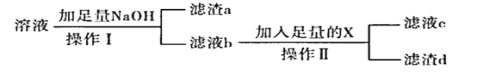
(1)请利用下图给定的仪器组成一套实验装置(每个仪器只能使用一次,可不选用)。各种仪器连接的先后顺序(用小写字母表示)_______

(2)除了测定产生气体的体积外,还应测定_______。
(3)回收流程中,操作I需要的玻璃仪器有烧杯、玻璃棒和_______,为保证回收产品的纯度,操作I后应_______。
(4)滤液b的溶质是_______(填化学式),试剂X是_______。
(5)向滤渣a中加入盐酸,产物是_______(填化学式),若从晶体中获得金属,应进行的操作是_______。
(6)若从除去涂层的手机壳上取样品mg加入足量盐酸后,测得产生的气体nL,实验条件下的气体摩尔体积为VmL/mol,则合金中Mg的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某一气态平衡体系中含有X、Y、Z、W四种气体物质,此温度下发生反应的平衡常数表达式为:![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K增大 ,则正反应为吸热反应
B.增大压强,W质量分数增加
C.增大X浓度,平衡向正反应方向移动
D.升高温度,若混合气体的平均相对分子质量变大,则正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】口服抗菌药利君沙的制备原料E和某种广泛应用于电子电器领域的高分子化合物H的合成路线如下:
已知:

I、核磁共振氢谱显示E分子中有两组峰,且峰面积比为2:1
Ⅱ、![]()
![]()
![]()
Ⅲ、
回答下列问题:
(1)丙烯的结构简式为_______________;E的分子式为_____________________;
(2)B分子中官能团的名称为__________________;G的名称为_______________________。
(3)由甲苯生成F的反应类型为_________________。
(4)写出C→D的化学方程式________________________________________________。
(5)满足下列条件的G的同分异构体有_________种。
①苯环上有三个取代基。②遇![]() 溶液发生显色反应。
溶液发生显色反应。
③能和![]() 溶液反应生成
溶液反应生成![]() 。
。
(6)写出1,3-丁二烯(![]() )和乙二醇(
)和乙二醇(![]() )为某原料制备聚酯纤维
)为某原料制备聚酯纤维 的合成路线________________(无机试剂任选)。
的合成路线________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A常用作有机合成的中间体,其质谱图表明其相对分子质量为84。已知16.8 g A完全燃烧生成44.0 g CO2和14.4 g H2O。请回答下列问题:
(1)A的分子式是____________。
(2)若红外光谱分析表明A分子中含有羟基和位于分子一端的C≡C键,且核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1,则A的结构简式是_______。
(3)有机物B是A的同分异构体,1 mol B可与1 mol Br2加成。该有机物中所有碳原子在同一个平面上,没有顺反异构现象。写出B与新制氢氧化铜反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水FeCl2易吸湿、易被氧化,常作为超高压润滑油的成分。某实验小组利用无水FeCl3和氯苯(无色液体,沸点132.2℃)制备少量无水FeCl2,并测定无水FeCl2的产率。
实验原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑
2FeCl2+C6H4Cl2+HCl↑
实验装置:按如图所示组装好的装置,检查气密性后,向三颈烧瓶A中加入16.76g无水FeCl3和22.5g氯苯。
回答下列问题:

(1)利用工业氮气(含有H2O、O2、CO2)制取纯净干燥的氮气。
①请从下列装置中选择必要的装置,确定其合理的连接顺序:a→________→上图中的j口(按气流方向,用小写字母表示)。

②实验完成后通入氮气的主要目的是________。
(2)装置C中的试剂是________(填试剂名称),其作用是________。
(3)启动搅拌器,在约126℃条件下剧烈搅拌30min,物料变成黑色泥状。加热装置A最好选用__(填字母)。
a.酒精灯 b.水浴锅 c.电磁炉 d.油浴锅
(4)继续升温,在128~139℃条件下加热2h,混合物颜色逐渐变浅,黏度降低。该步骤中加热温度已经接近或超过氯苯沸点,但氯苯实际损失量却非常小,其原因是________。
(5)继续加热1h后放置冷却,在隔绝空气条件下过滤出固体,用洗涤剂多次洗涤所得固体,置于真空中干燥,得到成品。若D中所得溶液恰好与25mL2.0mol·L-1NaOH溶液完全反应,则该实验中FeCl2的产率约为________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含Ni的单核六配位配合物,其阳离子空间结构为八面体。1mol该配合物的稀水溶液与足量![]() 混合生成
混合生成![]() 沉淀233g;将溶液过滤,滤液与硝酸银溶液混合不生成沉淀。元素分析表明该配合物所含部分原子个数比为
沉淀233g;将溶液过滤,滤液与硝酸银溶液混合不生成沉淀。元素分析表明该配合物所含部分原子个数比为![]() 。
。
(1)请画出Ni的价电子排布图:______________________,H、N、O的电负性由大到小的顺序为______________________。
(2)滤液与硝酸银溶液混合不生成沉淀的原因是___________________________________。
(3)该配合物阴离子的中心原子杂化方式为____________,请写出该配合物的化学式:________________。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可以在多个原子间运动,形成“离域![]() 键”。下列微粒中存在“离域
键”。下列微粒中存在“离域![]() 键”的是_________
键”的是_________![]() 填序号
填序号![]() 。
。
A.![]()
![]()
![]()
![]() 苯
苯
(5)如图是六方NiAs晶胞的晶胞图及坐标参数,其中![]() ,
,![]() ,
,![]() 。晶胞顶点、棱上小球为Ni,As在体内。
。晶胞顶点、棱上小球为Ni,As在体内。
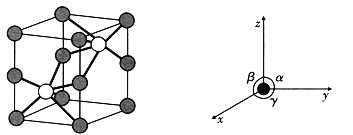
①写出As的配位数为_________,Ni的配位数为_________。
②已知晶胞参数为![]() ,
,![]() ,则晶胞的密度为____________
,则晶胞的密度为____________![]() 写表达式
写表达式![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下列科普短文,回答问题。
国家卫健委公布的《新型冠状病毒肺炎诊疗方案(试行》中提到:在相对封闭环境中,长时间暴露于高浓度气溶胶情况下,新冠病毒存在经气溶胶传播的可能。佩戴医用外科口罩可起到防护作用,含有病毒的飞沫会被口罩中间层熔喷无纺布(主要材质是聚丙烯)吸附。消毒也是控制病毒传播的有效措施,《新型冠状病毒肺炎流行期间预防性消毒指引》建议:表面消毒可选择含氯消毒剂、__%酒精,食饮具需要煮沸消毒15分钟以上。
(1)气溶胶中粒子的大小为_______.
a.< lnm b.> 100nm c.1nm~100nm
(2)丙烯在催化剂条件下制备聚丙烯,化学反应方程式为_______________
(3) 75%酒精的有效成分是乙醇,乙醇的一种同分异构体的结构简式为__________。
(4)食饮具可通过煮沸消毒,病毒蛋白质在加热条件下发生了______。
(5)环氧乙烷是一种低温灭菌剂, 经典的生产方法是氯代乙醇法,包括两步反应:
i.CH2=CH2+Cl2+H2O →ClCH2CH2OH+HCl
ii.ClCH2CH2OH+ HCl+Ca(OH)2 → ![]() + CaCl2 +2H2O
+ CaCl2 +2H2O
现代石油化工采用低温催化法: 2CH2=CH2+O2![]()
![]()
与氯代乙醇法相比,低温催化法的优点有________、_________. ( 答两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
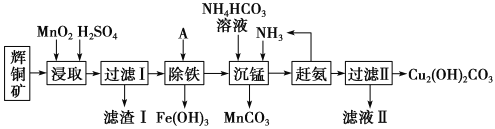
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=2.0×10-36
③Cu2S遇酸时会生成S
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________(任写一种)。
(2)滤渣I中的主要成分是______________。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_______,请用离子方程式表示用CuO“除铁”时所发生的反应__,若加A调节溶液pH后溶液中Fe3+的浓度为2.0×10-9mol/L,则pH为__。
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:_________________________。
(5)Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K= ________(填写计算结果);若不考虑CO32-的水解,要使46.6g BaSO4恰好完全转化为BaCO3,则至少需要浓度为1mol·L-1Na2CO3溶液 ____mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com