
【题目】有一含Ni的单核六配位配合物,其阳离子空间结构为八面体。1mol该配合物的稀水溶液与足量![]() 混合生成
混合生成![]() 沉淀233g;将溶液过滤,滤液与硝酸银溶液混合不生成沉淀。元素分析表明该配合物所含部分原子个数比为
沉淀233g;将溶液过滤,滤液与硝酸银溶液混合不生成沉淀。元素分析表明该配合物所含部分原子个数比为![]() 。
。
(1)请画出Ni的价电子排布图:______________________,H、N、O的电负性由大到小的顺序为______________________。
(2)滤液与硝酸银溶液混合不生成沉淀的原因是___________________________________。
(3)该配合物阴离子的中心原子杂化方式为____________,请写出该配合物的化学式:________________。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可以在多个原子间运动,形成“离域![]() 键”。下列微粒中存在“离域
键”。下列微粒中存在“离域![]() 键”的是_________
键”的是_________![]() 填序号
填序号![]() 。
。
A.![]()
![]()
![]()
![]() 苯
苯
(5)如图是六方NiAs晶胞的晶胞图及坐标参数,其中![]() ,
,![]() ,
,![]() 。晶胞顶点、棱上小球为Ni,As在体内。
。晶胞顶点、棱上小球为Ni,As在体内。
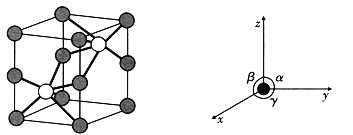
①写出As的配位数为_________,Ni的配位数为_________。
②已知晶胞参数为![]() ,
,![]() ,则晶胞的密度为____________
,则晶胞的密度为____________![]() 写表达式
写表达式![]() 。
。
【答案】![]()
![]() 氯与Ni形成配位键不能解离,故不与
氯与Ni形成配位键不能解离,故不与![]() 形成沉淀
形成沉淀 ![]() 杂化
杂化 ![]()
![]()
![]() 6
6 ![]()
【解析】
![]() 的价电子排布式为
的价电子排布式为![]() ,所以排布图为
,所以排布图为![]() ;非金属性越强,电负性越大,所以电负性大小顺序为
;非金属性越强,电负性越大,所以电负性大小顺序为![]() ;
;
![]() 由于配合物中有氯,但是加硝酸银却没有现象,说明氯没有在配合物的外界形成阴离子,所以氯应该是和Ni形成了配位键,所以不与
由于配合物中有氯,但是加硝酸银却没有现象,说明氯没有在配合物的外界形成阴离子,所以氯应该是和Ni形成了配位键,所以不与![]() 形成沉淀;
形成沉淀;
![]() 根据产生硫酸钡沉淀可知阴离子为硫酸根离子,硫酸根离子中硫是
根据产生硫酸钡沉淀可知阴离子为硫酸根离子,硫酸根离子中硫是![]() 杂化;由于配合物为单核六配位配合物,其阳离子空间结构为八面体,元素分析表明该配合物所含部分原子个数比为
杂化;由于配合物为单核六配位配合物,其阳离子空间结构为八面体,元素分析表明该配合物所含部分原子个数比为![]() ,所以有6个配体,一个为氯,其余为
,所以有6个配体,一个为氯,其余为![]() ,其化学式为
,其化学式为![]() ;
;
![]() 中S和苯中的C采取
中S和苯中的C采取![]() 杂化,原子在同一平面,有相互平行的p轨道,则p电子可以在多个原子间运动,形成“离域
杂化,原子在同一平面,有相互平行的p轨道,则p电子可以在多个原子间运动,形成“离域![]() 键”,B和C中
键”,B和C中![]() 和
和![]() 的中心原子都是
的中心原子都是![]()
![]() 键”;
键”;
答案选AD;
![]() 根据晶胞结构看出As周围最近的Ni有6个;根据化学式NiAs判断两种原子个数比为
根据晶胞结构看出As周围最近的Ni有6个;根据化学式NiAs判断两种原子个数比为![]() ,所以Ni的配位数也为6;一个晶胞有2个NiAs,体积为
,所以Ni的配位数也为6;一个晶胞有2个NiAs,体积为![]() ,所以密度为
,所以密度为![]() 。
。


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】能源危机当前是一个全球性问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是__(填字母)。
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,不使用煤、石油等化石燃料
D.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
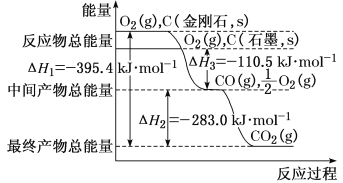
①在通常状况下,金刚石和石墨相比较,__(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为ΔH=___。
②12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为__kJ。
(3)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497kJ·mol-1。N2(g)+O2(g)=2NO(g)ΔH=+180.0kJ·mol-1。NO分子中化学键的键能为__。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工艺即化工技术或化学生产技术,指将原料物主要经过化学反应转变为产品的方法和过程,包括实现这一转变的全部措施。工业上用赤铁矿(含![]() 、
、![]() ,也含有
,也含有![]() 、
、![]() 、
、![]() 、
、![]() 等)制备绿矾
等)制备绿矾![]() 的工艺流程如下图:
的工艺流程如下图:
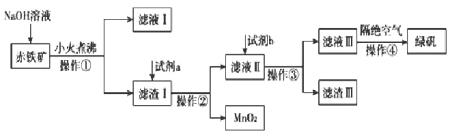
(1)操作①的名称是______________。
(2)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为_________、__________。
(3)向滤渣Ⅰ中加入过量的试剂a名称为__________,加入过量试剂b后所得滤渣Ⅲ的主要成分化学式为__________。
(4)操作③需要的玻璃仪器主要包括________________。
(5)操作④需要隔绝空气的主要原因可能是什么?___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的氧化剂与还原剂及部分产物如下所示:2Mn2+ + 5IO4— + …… → 2MnO4— + ……已知该反应体系还包括H+、H2O与另一种含碘微粒。对于该氧化还原反应说法正确的是
A.Mn2+是氧化剂,IO4—是还原剂
B.体系中另一种含碘微粒为I—
C.随着反应进行,溶液pH不断上升
D.每有1 mol IO4—参加反应,转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、M、R五种短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | |
原子半径/nm | 0.074 | 0.099 | |||
主要化合价 | +4,-4 | -2 | -1,+7 | ||
其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 第三周期简单离子半径最小 |
请回答下列问题:
(1)Z与NaOH溶液反应的离子方程式:___。(用元素符号表示,下同。)
(2)下列事实能说明R非金属性比Y强这一结论的是___(选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.气态氢化物稳定性R>Y
c.Y与R形成的化合物中Y呈正价
d.Y与R各自形成的含氧酸中R的氧化性更强
(3)经测定X2M2为二元弱酸,写出X2M2的电子式___。其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式___。
(4)已知I2能做X2M2分解的催化剂:
第一步:X2M2+I2=2XIM;
第二步:……
请写出第二步反应的化学方程式___。
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用X2M2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2![]() CO2+H2O.下列有关说法正确的是( )
CO2+H2O.下列有关说法正确的是( )
A.HCHO分子中C的杂化类型为sp3杂化
B.CO2分子中的化学键为非极性键
C.HCHO分子中含σ键,又含π键
D.每生成1.8gH2O消耗2.24LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水晒盐后的盐卤中含Br-,可提取Br2,流程如图:
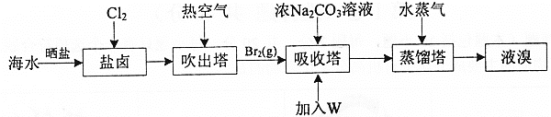
已知:①3Br2+3CO![]() = 5Br- +BrO
= 5Br- +BrO![]() +3CO2↑②5Br- +BrO
+3CO2↑②5Br- +BrO![]() +6H+ =3Br2 +3H2O
+6H+ =3Br2 +3H2O
下列说法不正确的是
A.海水晒盐能实现溴元素的富集
B.通入Cl2后发生反应: 2Br- +Cl2= Br2 +2Cl-
C.吸收塔中加入W溶液后得到Br2,W可以是硝酸
D.海水中Br-的浓度约为66mg·L-1 ,若该工艺总提取率为60%,1m3海水能制得39.6g Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶体硅是良好的半导体材料,它的发现和使用引起了计算机的一场“革命”。它可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
下列说法不正确的是( )
A.步骤③中氢气作还原剂
B.硅和二氧化硅都能用作计算机“芯片”
C.步骤①的化学方程式为:SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.步骤①②③中发生的反应都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为Zn-聚苯胺二次电池的示意图,下列说法正确的是( )
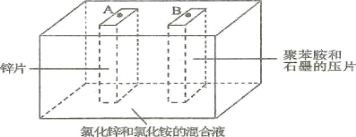
A.放电时,Zn片做负极,发生的电极方程式为Zn + 2e-=Zn2+
B.放电时,混合液中的Cl-向B移动
C.充电时,聚苯胺被氧化
D.充电时,A端接电源的正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com