
【题目】阅读下列科普短文,回答问题。
国家卫健委公布的《新型冠状病毒肺炎诊疗方案(试行》中提到:在相对封闭环境中,长时间暴露于高浓度气溶胶情况下,新冠病毒存在经气溶胶传播的可能。佩戴医用外科口罩可起到防护作用,含有病毒的飞沫会被口罩中间层熔喷无纺布(主要材质是聚丙烯)吸附。消毒也是控制病毒传播的有效措施,《新型冠状病毒肺炎流行期间预防性消毒指引》建议:表面消毒可选择含氯消毒剂、__%酒精,食饮具需要煮沸消毒15分钟以上。
(1)气溶胶中粒子的大小为_______.
a.< lnm b.> 100nm c.1nm~100nm
(2)丙烯在催化剂条件下制备聚丙烯,化学反应方程式为_______________
(3) 75%酒精的有效成分是乙醇,乙醇的一种同分异构体的结构简式为__________。
(4)食饮具可通过煮沸消毒,病毒蛋白质在加热条件下发生了______。
(5)环氧乙烷是一种低温灭菌剂, 经典的生产方法是氯代乙醇法,包括两步反应:
i.CH2=CH2+Cl2+H2O →ClCH2CH2OH+HCl
ii.ClCH2CH2OH+ HCl+Ca(OH)2 → ![]() + CaCl2 +2H2O
+ CaCl2 +2H2O
现代石油化工采用低温催化法: 2CH2=CH2+O2![]()
![]()
与氯代乙醇法相比,低温催化法的优点有________、_________. ( 答两点)
【答案】75 c nCH3CH=CH2![]()
![]() CH3OCH3 变性 原子利用率100% (或原子经济性高),不产生CaCl2等工业废渣 对设备腐蚀性小、低温催化能耗低
CH3OCH3 变性 原子利用率100% (或原子经济性高),不产生CaCl2等工业废渣 对设备腐蚀性小、低温催化能耗低
【解析】
表面消毒可选择含氯消毒剂、体积分数为75%的酒精,故答案为:75;
(1)分散质粒子直径在1nm~100nm之间的分散系为胶体,气溶胶中粒子的大小为1nm~100nm,故答案选c;
(2)丙烯在催化剂条件下制备聚丙烯,化学反应方程式为:nCH3CH=CH2![]()
![]() ;
;
(3)乙醇的分子式是C2H6O,饱和一元醇和饱和一元醚属于类别异构,乙醇的同分异构体是乙醚,其结构简式是CH3OCH3;
(4)加热可以使蛋白质变性,所以病毒蛋白质在加热条件下发生了变性;
(5)氯代乙醇法生产环氧乙烷,原子利用率没有达到100%,并且有CaCl2等工业废渣产生;现代石油化工采用低温催化法:2CH2=CH2+O2![]()
![]() ,原子利用率100% (或原子经济性高),没有副产物,与氯代乙醇法相比,低温催化法的优点有原子利用率100% (或原子经济性高),不产生CaCl2等工业废渣、对设备腐蚀性小、低温催化能耗低等优点。
,原子利用率100% (或原子经济性高),没有副产物,与氯代乙醇法相比,低温催化法的优点有原子利用率100% (或原子经济性高),不产生CaCl2等工业废渣、对设备腐蚀性小、低温催化能耗低等优点。


科目:高中化学 来源: 题型:
【题目】某温度下,向体积为2L的恒容密闭容器中通入2molN2和6molH2,在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g)。实验测得反应经5min后达到平衡,此时混合物的总物质的量为5.6mol,求:
2NH3(g)。实验测得反应经5min后达到平衡,此时混合物的总物质的量为5.6mol,求:
(1)平衡时NH3的浓度为___mol·L-1。
(2)0~5min内,v(H2)=___mol·L-1·min-1。
(3)反应达到平衡时,N2的转化率为___。
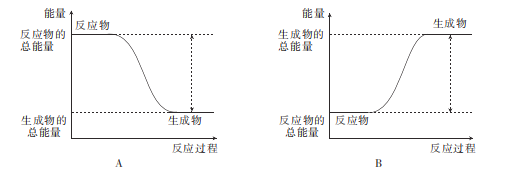
(4)下列图象中能反映该反应的能量变化的是___(填标号)。
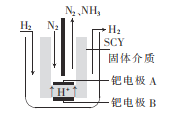
(5)若以N2和H2合成氨的反应设计如图所示的原电池,则通入N2的一极为__(填“正”或“负")极;负极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的氧化剂与还原剂及部分产物如下所示:2Mn2+ + 5IO4— + …… → 2MnO4— + ……已知该反应体系还包括H+、H2O与另一种含碘微粒。对于该氧化还原反应说法正确的是
A.Mn2+是氧化剂,IO4—是还原剂
B.体系中另一种含碘微粒为I—
C.随着反应进行,溶液pH不断上升
D.每有1 mol IO4—参加反应,转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2![]() CO2+H2O.下列有关说法正确的是( )
CO2+H2O.下列有关说法正确的是( )
A.HCHO分子中C的杂化类型为sp3杂化
B.CO2分子中的化学键为非极性键
C.HCHO分子中含σ键,又含π键
D.每生成1.8gH2O消耗2.24LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水晒盐后的盐卤中含Br-,可提取Br2,流程如图:
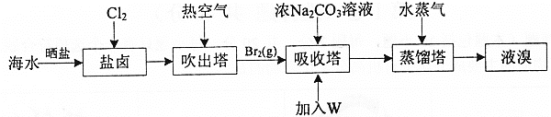
已知:①3Br2+3CO![]() = 5Br- +BrO
= 5Br- +BrO![]() +3CO2↑②5Br- +BrO
+3CO2↑②5Br- +BrO![]() +6H+ =3Br2 +3H2O
+6H+ =3Br2 +3H2O
下列说法不正确的是
A.海水晒盐能实现溴元素的富集
B.通入Cl2后发生反应: 2Br- +Cl2= Br2 +2Cl-
C.吸收塔中加入W溶液后得到Br2,W可以是硝酸
D.海水中Br-的浓度约为66mg·L-1 ,若该工艺总提取率为60%,1m3海水能制得39.6g Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期。
(1)![]() 原子基态时外围电子轨道表示式为______;
原子基态时外围电子轨道表示式为______;
(2)由A、B、C形成的离子![]() 与
与![]() 互为等电子体,则
互为等电子体,则![]() 的结构式为______;
的结构式为______;
(3)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”
键”![]() 或大
或大![]() 键
键![]() 。大
。大![]() 键可用
键可用![]() 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大![]() 键的电子数和原子个数,如苯分子中大
键的电子数和原子个数,如苯分子中大![]() 键表示为
键表示为![]()
①下列微粒中存在“离域![]() 键”的是______;
键”的是______;
![]()
![]()
②![]() 分子中大
分子中大![]() 键可以表示为______;
键可以表示为______;
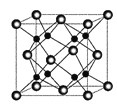
(4)![]() 和D能够形成化合物X,其晶胞结构如图所示,晶胞参数
和D能够形成化合物X,其晶胞结构如图所示,晶胞参数![]() ,晶胞中C原子的配位数为______;列式计算晶体X的密度______
,晶胞中C原子的配位数为______;列式计算晶体X的密度______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶体硅是良好的半导体材料,它的发现和使用引起了计算机的一场“革命”。它可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
下列说法不正确的是( )
A.步骤③中氢气作还原剂
B.硅和二氧化硅都能用作计算机“芯片”
C.步骤①的化学方程式为:SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.步骤①②③中发生的反应都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家借助自主研制的新型钨钴铁合金催化剂攻克了可控结构单壁碳纳米管的制备难题。海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的金属资源,含有钨、铁、锰、锌、钴等。
(1)基态铬原子的核外未成对电子数为________。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为________。
(2)纳米结构氧化钴可在室温下将甲硫醛![]() 完全催化氧化,甲硫醛分子的中心原子的VSEPR构型为________,其分子中
完全催化氧化,甲硫醛分子的中心原子的VSEPR构型为________,其分子中![]() 键与
键与![]() 键的个数比为________。
键的个数比为________。
(3)六羰基钨![]() 的熔点为
的熔点为![]() ,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种组成元素的第一电离能由小到大的顺序为________
,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种组成元素的第一电离能由小到大的顺序为________![]() 填元素符号
填元素符号![]() 。配体CO中与W形成配位键的原子是C非O,原因是________________________。
。配体CO中与W形成配位键的原子是C非O,原因是________________________。
(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”。下列分子中存在“离域
键”。下列分子中存在“离域![]() 键”的有________
键”的有________![]() 填字母
填字母![]() 。
。
A.环己烷 ![]() 二氧化硫
二氧化硫 ![]() 三氟化氮
三氟化氮 ![]() 苯酚
苯酚
(5)![]() 、
、![]() 能与
能与![]() 络合形成络离子,其结构如图1所示。该络离子与钾离子可形成华蓝钾盐,该钾盐的化学式为________。
络合形成络离子,其结构如图1所示。该络离子与钾离子可形成华蓝钾盐,该钾盐的化学式为________。
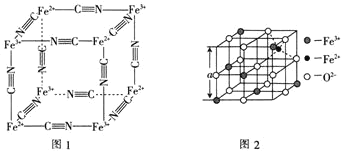
(6)图2是从铁氧体离子晶体![]() 中取出的能体现其晶体结构的一个立方体。已知
中取出的能体现其晶体结构的一个立方体。已知![]() 晶体的密度为
晶体的密度为![]() ,则图2中
,则图2中![]() ________
________![]() 已知
已知![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为___________,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是________,VO43-的几何构型为________.
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。

①基态S原子中原子核外未成对电子数为_______,该药物中S原子的杂化方式是_______.所含第二周期元素第一电离能按由大到小顺序的排列是___________.
②2-巯基烟酸(图2) 水溶性优于2-巯基烟酸氧钒配合物的原因是_________.
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是_____.
A.SO2 B.SO42- C.H2S D.CS2
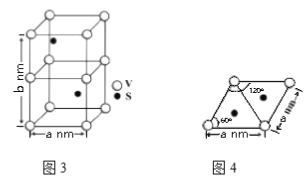
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为______。图4 为该晶胞的俯视图,该晶胞的密度为________g/cm3 (列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com