
【题目】以有机物A为原料通过一步反应即可制得重要有机化工产品P( )。下列说法错误的是
)。下列说法错误的是
A.A的分子式为C11H14,可发生取代、氧化、加成等反应
B.由A生成P的反应类型为加成聚合反应,反应过程没有小分子生成
C.A的结构简式为![]() ,分子中所有碳原子不可能共面
,分子中所有碳原子不可能共面
D.1 mol A最多能与4 mol H2发生加成反应
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
C.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D.已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的 稀溶液混合,则放出的热量大于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2经催化加氢可合成乙烯:2CO2 (g) +6H2 (g) ![]() C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是
C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是

A. 该反应的△H<0
B. 曲线b代表H2O
C. N点和M点所处状态的c(H2)不一样
D. 其它条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3丙二醇是生产新型高分子材料PTT的主要原料,目前,1,3丙二醇的生产路线有:以石油裂解气为原料的两条石油化工合成路线和一条生物工程法合成路线。
(路线1)丙烯醛水合氢化法:CH2=CHCH3![]() CH2=CHCHO―→
CH2=CHCHO―→![]()
![]() HO-CH2CH2CH2-OH
HO-CH2CH2CH2-OH
(路线2)环氧乙烷甲酰化法:
![]()
![]() HO-CH2CH2CH2-OH
HO-CH2CH2CH2-OH
(路线3)生物发酵法:淀粉![]() 甘油
甘油![]() 1,3丙二醇
1,3丙二醇
(1)A的结构简式为_________________。
(2)从合成原料来源的角度看,你认为最具有发展前景的路线是_____(填“1”、“2”或“3”),理由是___________。
(3)以1,3丙二醇与对苯二甲酸为原料可以合成聚酯PTT,写出其化学方程式________。
(4)已知丙二酸二乙酯能发生以下反应:
CH2(COOC2H5)2![]() CH3CH(COOC2H5)2
CH3CH(COOC2H5)2![]()
![]() 利用该反应原理,以丙二酸二乙酯、1,3丙二醇、乙醇为原料合成
利用该反应原理,以丙二酸二乙酯、1,3丙二醇、乙醇为原料合成![]() ,请你设计出合理的反应流程图。________
,请你设计出合理的反应流程图。________
提示①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
A![]() B
B![]() C……
C……
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是( )
A.中子数为20的氯原子:20Cl
B.乙酸乙酯的结构简式:CH3CH2OOCCH3
C.甲醛的电子式: ![]()
D.2,4,6-三硝基甲苯的结构简式: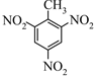
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液滴定0.100mol/L浓度均为0.100mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( )
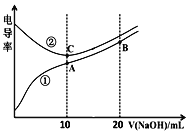
A. 曲线①代表滴定CH3COOH溶液的曲线
B. A、C两点对应溶液均呈中性
C. B点溶液中:c(Na+)>c(OH-)>c(CH3COO-)
D. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种重要的有机合成中间体,它的合成路线如下:
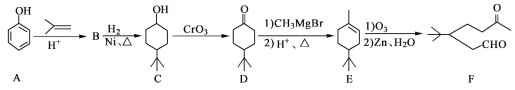
(1)化合物F中含氧官能团的名称是_________和_________。
(2)由B生成C的化学反应类型是________。
(3)写出化合物B的结构简式:__________。
(4)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢。写出该化合物的结构简式:__________(任写一种)。
(5)请根据已有知识并结合相关信息,写出以苯酚(![]() )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物![]() 的合成路线流程图_____________________________(无机试剂任用)。
的合成路线流程图_____________________________(无机试剂任用)。
合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 对于A(s)+B(g) ![]() C(g)+D(g)的反应,加入A,反应速率加快
C(g)+D(g)的反应,加入A,反应速率加快
B. 2NO2![]() N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
C. 一定温度下,反应 N2(g)+3H2(g) ![]() 2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
D. 100 mL2 mol·L—1稀盐酸与锌反应时,加入少量硫酸铜固体,生成氢气的速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com