
【题目】常温下,用0.10molL-1NaOH溶液分别滴定20.00mL0.10molL-1的HX和HY溶液,滴定曲线如图所示。下列说法正确的是( )

A.pH=7时,滴定HX消耗NaOH溶液体积等于20.00mL
B.将上述HX、HY溶液各加水稀释10倍,稀释后溶液的pH:pH(HY)>pH(HX)
C.当NaOH溶液体积为20.00mL时,HX溶液中离子浓度:c(Na+)>c(X-)>c(H+)>c(OH-)
D.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,c(H+)+c(HX)=c(OH-)
【答案】D
【解析】
根据图知,未加NaOH溶液时,HY溶液的![]() ,说明HY溶液中
,说明HY溶液中![]() ,则HY是强酸,HX溶液的
,则HY是强酸,HX溶液的![]() ,则HX为弱酸;
,则HX为弱酸;
A.HX为弱酸,NaX溶液呈碱性,如果混合溶液![]() ,说明溶液呈中性,溶液中溶质为HX和NaX,此时酸的体积大于碱,则
,说明溶液呈中性,溶液中溶质为HX和NaX,此时酸的体积大于碱,则![]() ,故A错误;
,故A错误;
B.HX是弱电解质,加水稀释促进HX电离,HY是强酸,完全电离,物质的量浓度相同的HX和HY稀释相同的倍数后![]() :
:![]() ,所以溶液的pH:
,所以溶液的pH:![]() ,故B错误;
,故B错误;
C.当NaOH溶液体积为![]() 时,酸碱恰好完全反应生成NaX,溶液呈碱性,则
时,酸碱恰好完全反应生成NaX,溶液呈碱性,则![]() ,根据电荷守恒得:
,根据电荷守恒得:![]() ,水的电离程度很小,所以离子浓度大小顺序是
,水的电离程度很小,所以离子浓度大小顺序是![]() ,故C错误;
,故C错误;
D.溶液中存在质子守恒,根据质子守恒得![]() ,故D正确;
,故D正确;
故答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东阿广场十一期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如图,下列关于该物质的说法正确的是
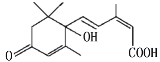
A.其分子式为C15H22O4
B.1 mol该物质与足量NaOH溶液反应,最多消耗2 mol NaOH
C.既能发生加聚反应,又能发生缩聚反应
D.该物质中sp3杂化的C原子和氧原子形成的化学键键角相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. 油脂在人体内水解为氨基酸和甘油等小分子后被人体吸收
B. 甲酸甲酯(HCOOCH3)和乙酸是同分异构体
C. 石油催化裂化的主要目的是提高芳香烃的产量
D. 聚丙烯的结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
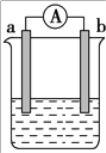
(1)当电极 a 为 Al,电极 b 为 Cu,电解质溶液为浓硝酸时,该电池的 负极为_________(填“Al”或“Cu”),正极的电极反应式为___________。
(2)当电极 a 为 Al,电极 b 为 Mg,电解质溶液为氢氧化钠溶液时,该 电池负极的电极反应式为_____,当反应中收集到标准状况下 224 mL 气体时,消耗的电极质量为_____g。
(3)燃料电池的工作原理是将燃料和氧化剂(如 O2)反应所产生的能量直接转化为电能。现设计一种燃料电池,以对气体吸附能力很强的 Pt 作为两个电极,甲烷为燃料,采用氢氧化钠溶液 为电解质溶液,则通甲烷的电极为_____极(填“正”或“负”),该电池正极的电极反应式 为_____,该电池工作一段时间后,溶液中OH-的浓度将_____(填“增 大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃是重要的有机化工原料。实验室主要用浓硫酸或浓磷酸作催化剂使醇脱水制取烯烃。某同学使用环己醇脱水制备环己烯。设计方案如下:
(一)主要仪器和试剂
仪器:50mL圆底烧瓶、分馏柱、直形冷凝管、10mL量筒、分液漏斗、100mL锥形瓶、蒸馏头、接液管。
试剂:10.0g(10.4mL,0.1mol)环己醇、5mL浓磷酸、氯化钠、无水氯化钙、5%碳酸钠水溶液。
(二)查阅实验所涉及的反应物、催化剂、产物的各种物理性质,列表如下:
化学物质 | 相对分子 质量 | 相对密度/ g·cm-3 | 沸点/℃ | 溶解性 |
环己醇 | 100 | 0.96 | 161.1 | 稍溶于水 |
磷酸(85%) | 98 | 1.83 | 213 | 易溶于水 |
环己烯 | 82 | 0.89 | 83.3 | 微溶于水 |
(三)实验流程

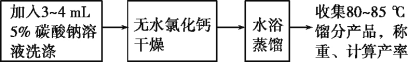
请回答:
(1)加热过程中,若忘记加沸石,应如何操作?___
(2)将粗产品分去水层所需要用到的主要实验仪器是___。
(3)本实验用浓磷酸代替浓硫酸的优点:___。
(4)该实验的主要副产物为___(填物质名称)。
(5)在提纯环己烯时,用等体积的饱和食盐水,而不用水的原因是___。加入3~4mL5%碳酸钠溶液的目的是___。
(6)水浴蒸馏最后得到7.0g产品,则反应的产率为___(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子反应方程式为
A.NH4HCO3溶于少量的浓KOH溶液中:![]() +
+![]() +2OH-=
+2OH-=![]() + NH3↑+2H2O
+ NH3↑+2H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使![]() 沉淀完全:2Al3++3
沉淀完全:2Al3++3![]() +3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2 Fe3++2Br2+6 Cl-
D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池反应为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)。下列说法正确的是( )
2PbSO4(s)+2H2O(l)。下列说法正确的是( )
A.放电时Pb为正极,发生还原反应
B.放电时电解质溶液中的H+向负极移动
C.充电时阳极的电极反应为:PbSO4(s)-2e-=Pb(s)+SO![]() (aq)
(aq)
D.充电时阳极附近电解质溶液的pH逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com