
【题目】在含有大量的Ba2+、OH﹣、NO3﹣的溶液中,还可能大量共存的离子是( )
A.H+
B.NH4+
C.CO32﹣
D.Cl﹣
科目:高中化学 来源: 题型:
【题目】为了测定铁铜合金的组成,将7.6g铁、铜合金加入100mL某浓度的稀硝酸中,待合金完全溶解后,共收集到NO气体2.24L(标准状况下),并测得溶液中H+的浓度为0.5molL﹣1 . 若反应前后溶液的体积变化忽略不计,则下列判断正确的是( )
A.上述反应中金属共失去电子0.1 mol
B.合金中,铜的质量为2.8 g
C.原硝酸的浓度:c(HNO3)=4.5 molL﹣1
D.要使溶液中的金属离子完全沉淀,需加5 molL﹣1的NaOH溶液60 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液(1)汽油和氯化钠溶液;(2)酒精和水的混合溶液;(3)氯化钠和单质溴的溶液;以上混合溶液分离的正确方法依次是( )
A.分液、萃取、蒸馏B.萃取、蒸馏、分液
C.分液、蒸馏、萃取D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在常温下,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( ) 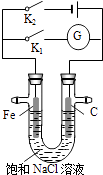
A.K1闭合,铁棒上发生的反应为2H++2e﹣═H2↑
B.K1闭合,石墨棒周围溶液pH逐渐降低
C.K2闭合,铁棒不易被腐蚀,电路中通过0.001NA个电子时,摇匀后溶液的pH为11
D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原2.4×10﹣3mol [XO(OH)]2+ 到X元素的低价态时,需消耗30mL 0.2mol·L﹣1的亚硫酸钠(Na2SO3)溶液,则在此反应中X元素的低价态为( )
A. 0价 B. +1价 C. ﹣1价 D. ﹣2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(反应条件及副产物已略去)。
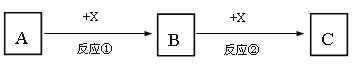
(1)若A、B、C均为含有同种非金属元素的化合物,A为使湿润的红色石蕊试纸变蓝的气体,B接触空气立刻变为C,则反应①的化学方程式为_______________________。
(2)若A、B、C为焰色反应均呈黄色的化合物,X为无色无味气体,则反应②的离子方程式为_____________________________________________。
(3)若A、B、C均为含有同种金属元素的化合物,X是强碱,则反应②的离子方程式为________________________________________________。
(4)若A为单质Fe,X为稀硝酸,则反应②的离子方程式为___________________;若向B的溶液中加入氢氧化钠溶液,现象为________________________________________,对应的化学方程式为___________________________________________。
(5)若A和X均为单质,B为可使品红溶液褪色的气体,则反应②的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、E为金属单质,B是淡黄色粉末且常用于防毒面具中,回答下题。
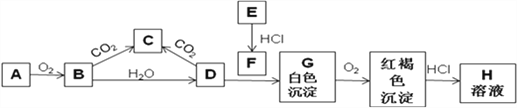
(1)实验室中A常常保存在盛放__________的广口瓶中。
(2)写出B转变成C的化学方程式_______________________。0.1molB参与该反应,转移电子的个数为_________ 。
(3)用化学方程式表示沉淀G颜色发生变化的原因:____________________________________________。
(4)从A、B、C、D、E、G、H选出试剂可制备F,写出对应离子方程式:______________________________________;
(5)直接向F溶液中加入B固体,写出可能出现的现象:______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一Na2SO4和Al2(SO4)3的混合溶液,已知其中A13+的物质的量浓度为0.5mol/L,SO42-的物质的量浓度为0.8 mol/L,则此溶液中Na+的物质的量浓度为( )
A.0.1mol/LB.0.15 mol/LC.0.2 mol/LD.0.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外实验小组从煤油中取出一块钠,用滤纸吸净其表面的煤油,用切刀切下数块,分别进行实验研究:
(1)切下的钠块表面变暗,其反应的化学方程式为________________。
(2)将其中一块钠放入坩埚中加热,反应现象为:________________________,反应的化学方程式是________________________。
(3)过氧化钠是钠的一种重要化合物,其中一种用途是用于呼吸面具或潜水艇中氧气的来源,涉及的主要反应的化学方程式为________________________。若15.6gNa2O2参加反应,则最多可制得标准状况下氧气的体积为________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com