
【题目】某同学设计一个电池(如下图所示),探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

(1)通入氢气的电极为________ (填正极或负极),该电极反应式为_______。
(2)石墨电极为________ (填阳极或阴极),乙中总反应离子方程式为________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_________(填“增大”“减小”或“不变”)。
(4)若甲中消耗0.01molO2,丙中精铜增重_________g。
【答案】负极 H2-2e-+2OH-=2H2O 阳极 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 减小 1.28
2OH-+H2↑+Cl2↑ 减小 1.28
【解析】
(1)燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,负极上失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
(2)铁电极连接原电池的负极,为电解池的阴极,石墨为阳极,所以乙中相当于惰性电极电解饱和食盐水,电解反应方程式为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(3)活泼性Zn>Cu>Ag,阳极上锌、铜被氧化,根据转移电子数相等判断;
(4)串联电池中转移电子数相等,根据转移电子数相等计算丙装置中阴极析出铜的质量。
(1)燃料电池中,通入燃料H2的电极是负极、通入氧化剂的电极是正极,负极上H2失电子发生氧化反应,电极反应为H2-2e-+2OH-=2H2O;
(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以Fe电极是阴极,发生的电极反应:2H++2e-=H2↑,则石墨电极是阳极,阳极上Cl-失去电子反应生成Cl2,电极反应式为:2Cl--2e-=Cl2↑,电解反应方程式为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(3)如果粗铜中含有锌、银等杂质,阳极上不仅铜,还有锌失电子进入溶液,阴极上Cu2+获得电子变为单质Cu析出,阳极电极方程式为Zn-2e-=Zn2+、Cu-2e-=Cu2+,根据转移电子数相等知,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小;
(4)若甲中消耗0.01mol O2,转移电子的物质的量n(e-)=4n(O2)=0.04mol,根据转移电子守恒得,丙装置中阴极上铜离子得电子生成铜单质,析出铜的质量m(Cu)=0.04mol×![]() ×64g/mol=1.28g。
×64g/mol=1.28g。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00 mL 0.049 mol·L-1羟胺的酸性溶液与足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.55 mL 0.020 mol·L-1酸性KMnO4溶液完全反应。已知(未配平):FeSO4+KMnO4+H2SO4 → Fe2(SO4)+K2SO4+MnSO4+H2O,则羟胺的氧化产物是
A. N2 B. N2O C. NO D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习中常用类推方法,下列类推正确的是![]()
A.![]() 为直线形分子,
为直线形分子,![]() 也为直线形分子
也为直线形分子
B.![]() 的沸点高于
的沸点高于![]() ,
,![]() 的沸点也高于
的沸点也高于![]()
C.![]() 中N原子是
中N原子是![]() 杂化,
杂化,![]() 中B原子也是
中B原子也是![]() 杂化
杂化
D.![]() 能溶于NaOH溶液,
能溶于NaOH溶液,![]() 也能溶于NaOH溶液
也能溶于NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________。
(3)0.1mol/L的NaHA溶液,测得溶液显酸性。则
①该溶液中c(H2A)________c(A2-)(填“>”、“<”或“=”)
②作出上述判断的依据是_______(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
绿矾为FeSO47H2O。常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=______。{Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )。
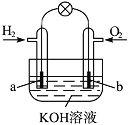
A.氢氧燃料电池是一种具有应用前景的绿色电源
B.a极是负极,该电极上发生氧化反应
C.总反应方程式为2H2+O2=2H2O
D.b极反应是O2+4OH--4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是( )
A. 由水电离产生的c(H+)=10-12mol/L的溶液中:K+、Na+、ClO-、I-
B. c(H+)=![]() mol/L的溶液中:K+、Fe3+、Cl-、CO32—
mol/L的溶液中:K+、Fe3+、Cl-、CO32—
C. 常温下,![]() =1×10-12的溶液:K+、AlO2—、CO32—、Na+
=1×10-12的溶液:K+、AlO2—、CO32—、Na+
D. pH=13的溶液中:AlO2—、Cl-、HCO3—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 时下列物质的溶度积
时下列物质的溶度积![]() 单位略
单位略![]() 。
。
| AgCl |
|
| |
|
|
|
|
|
下列说法正确的是![]()
A.等体积、浓度均为![]() 的
的![]() 和
和![]() 溶液混合能产生沉淀
溶液混合能产生沉淀
B.向含有浓度均为![]() 的
的![]() 和
和![]() 的溶液中慢慢滴入
的溶液中慢慢滴入![]() 溶液时,
溶液时,![]() 先沉淀
先沉淀
C.在![]() 悬浊液中加入盐酸时发生反应的离子方程式为
悬浊液中加入盐酸时发生反应的离子方程式为![]()
D.![]() 时,上述四种饱和溶液的物质的量浓度:
时,上述四种饱和溶液的物质的量浓度: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的有机物充分燃烧后的产物通入足量的石灰水中完全吸收,经过滤、洗涤、干燥得沉淀20g, 滤液质量比原石灰水减少7.6g,该有机物可能是( )
A.乙炔B.乙烷C.乙二醇D.乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L-1的盐酸和25.00 mL 0.1 mol·L-1氨水混合。
(1)当加入10.00 mL稀盐酸时,溶液中的溶质是________(填化学式),溶液的pH______(填“>”、“<”或“=”)7。
(2)当某一时刻溶液中c(NH4+)=c(Cl-),此时溶液的pH____(填“>”、“<”或“=”)7。所加的盐酸体积V ____(填“>”、“<”或“=”)25.00 mL。其原因是_______。
(3)某一时刻溶液中会不会存在:c(Cl-)>c(NH4+),且c(OH-)>c(H+)的关系?_____(填“会”或“不会”)。其原因是________。
(4)已知常温时 ,K(NH3·H2O)=1.8×10-5 当V(HCl)=12.50 mL时,下列离子浓度的大小关系是: c(Cl-) ___ c(NH4+) ,c(OH-) ___ c(H+)。(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com