
过氧化物是一类非常重要的化合物,从人们制得第一种过氧化物距今已有200多年的历史了,在众多的过氧化物中过氧化氢迄今为止仍然得到广泛的应用。
(1)与H2O2具有相同的电子总数的双原子分子有 (写两种);
(2)若从海水中提取碘,需将碘化物变成单质碘。写出在酸性条件下H2O2氧化I—离子的离子方程式 ;
(3)Na2O2、K2O2、CaO2和BaO2都能与酸作用生成H2O2,目前实验室制取H2O2可通过上述某种过氧化物与适量的稀H2SO4作用并过滤后获得,其中最适合的过氧化物是 (填化学式);
(4)纯H2O2可用作火箭燃料的氧化剂,已知0.4mol液态肼(N2H4)与足量的液态H2O2反应,生成N2(g)和H2O(g),放出256.6kJ的热量,则该反应的热化学方程式是 。
(1)HCl、F2(共2分,各1分)(2)H2O2+2I-+2H+= I2+2H2O(3分,没配平扣1分,其他错误0分)(3)BaO2(2分)(4)N2H4(l)+2H2O2(l) = N2(g)+4H2O(g) △H=-641.5kJ·mol-1(3分。没配平,没标状态,△H没标单位均扣1分,其他错误0分)
解析试题分析:(1)与H2O2具有相同的电子总数的双原子分子有HCl、F2;(2)酸性条件下H2O2氧化I—离子的离子方程式为H2O2+2I-+2H+= I2+2H2O;(3)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2 ;(4)0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1。
考点:双氧水的性质;热化学方程式的书写。


科目:高中化学 来源: 题型:填空题
某课外小组对一些金属单质和化合物的性质进行探究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[设其主要成分为Cu2(OH)2CO3] |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有浓度分别为1 mol/L的FeCl3、FeCl2、CuCl2混合溶液100 mL,加入一定量的铁粉,按下列情况填空。
(1)充分反应后,如果溶液中还有一定量的Cu2+,则溶液中一定含有的金属离子还有___________,该离子在溶液中的物质的量范围为________________,可能含有的金属或金属离子为____________。
(2)反应完毕后,铁粉有剩余,溶液中一定含有的金属离子为___________,为______mol,
一定没有的金属离子为______________。
(3)若向FeCl3溶液中加入适量氢碘酸,发生反应的离子方程式为____________________。
(4)某一反应体系中有反应物和生成物共五种物质:S,H2S,HNO3,NO,H2O。该反应的化学方程式为________________________________;若反应过程中转移了0.3mol电子,则氧化产物的质量是___________g;生成的气体在标况下的体积是________L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示。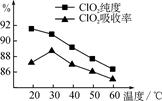
(1) 据图可知,反应时需要控制的适宜温度是________℃,要达到此要求需要采取的措施是______________。
(2) 已知:黄铁矿中的硫元素在酸性条件下可被ClO3-氧化成SO42-,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式:______________________。
(3) 该小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20 mL与37.00 mL 0.500 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:
4H++ClO2+5Fe2+=Cl-+5Fe3++2H2O
14H++Cr2O72-+6Fe2+=2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
写出下列化学方程式、离子方程式或电离方程式:
(1)碳酸钠溶液和过量的醋酸溶液反应(离子方程式)
(2)镁在二氧化碳气体中燃烧(化学方程式)
(3)次氯酸电离(电离方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有①铁片 ②NaCl溶液 ③氨水 ④醋酸 ⑤酒精 ⑥盐酸 ⑦H2SO4
⑧KOH固体 ⑨蔗糖 ⑩KAl(SO4)2·12H2O,其中能导电的是 ,属于电解质的是____ ___,属于非电解质的是 ,属于酸的是 ,属于碱的是 。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
⑴下列物质:①熔融氯化钠 ②盐酸 ③纯醋酸(CH3COOH) ④碳酸钙 ⑤酒精 ⑥二氧化碳 ⑦硫酸氢钠固体 ⑧铜 ⑨碳酸氢钠固体⑩氢氧化钡溶液,属于电解质的是 , 属于非电解质的是 ,能导电的是 。(用序号填空)
⑵写出物质③和⑨在水中反应的离子方程式: 。
⑶将物质⑦配制成溶液,逐滴滴入⑩中至Ba2+恰好沉淀完全,写出离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有以下物质:①Al;②稀硫酸;③NaHCO3;④液氨;⑤盐酸;⑥蔗糖溶液;⑦无水乙醇;⑧熔融NaOH;⑨NaHSO4;⑩CO2,回答下列问题(用相应物质的序号填写)
(1)可以导电的有 ;
(2)属于非电解质的有 ;
(3)请写出③的电离方程式 ;
(4)写出⑧中的物质的溶液与⑨的溶液反应的离子方程式 ;
(5)写出①与⑧中的物质的溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)
| 物质 | 需加入的试剂 | 有关离子方程式 |
| (1)HNO3(H2SO4) | | |
| (2)Cu(Fe) | | |
| (3)NaCl(Na2CO3) | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com