
【题目】日常生活中,汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH= -akJ/mol
2CO2(g) ΔH= -akJ/mol
②N2(g)+O2(g) ![]() 2NO(g) ΔH= +bkJ/mol
2NO(g) ΔH= +bkJ/mol
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH= -ckJ/mol
2NO2(g) ΔH= -ckJ/mol
回答下列问题:
(1)CO的燃烧热为____________________。
(2)CO将NO2还原为单质的热化学方程式为_____________________________。
(3)为了模拟反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率V(N2)=_________________________________。
②能说明上述反应达到平衡状态的是_______________。
A.2n(CO2)=n(N2)
B.混合气体的平均相对分子质量不变
C.气体密度不变
D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。
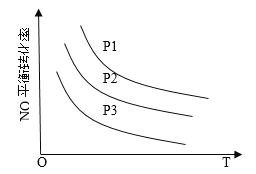
则NO的平衡转化率随温度升高而减小的原因是______________________________
图中压强(P1、P2、P3)的大小顺序为_____________________。
【答案】![]() kJ/mol 2NO2(g)+4CO(g)
kJ/mol 2NO2(g)+4CO(g) ![]() N2(g)+4CO2(g) ΔH=-(2a+b-c)kJ/mol 1.875×10-4mol·L-1·s-1 BD 该反应正反应放热,升高温度,平衡逆向移动,NO的平衡转化率减小 P1>P2>P3
N2(g)+4CO2(g) ΔH=-(2a+b-c)kJ/mol 1.875×10-4mol·L-1·s-1 BD 该反应正反应放热,升高温度,平衡逆向移动,NO的平衡转化率减小 P1>P2>P3
【解析】
(1)根据燃烧热的概念进行计算;(2)根据盖斯定律进行分析推导;(3)根据速率计算公式进行计算;(4)根据化学反应达到平衡的条件进行判断化学反应是否达到平衡状态;(5)根据温度和压强对化学反应平衡的影响进行分析。
(1)CO的燃烧热为1molCO完全燃烧生成CO2时放出的热量,所以由①2CO(g)+O2(g) ![]() 2CO2(g) ΔH= -akJ/mol可知,CO(g)+
2CO2(g) ΔH= -akJ/mol可知,CO(g)+![]() O2(g)
O2(g) ![]() CO2(g) ΔH= -
CO2(g) ΔH= -![]() kJ/mol,所以CO的燃烧热为
kJ/mol,所以CO的燃烧热为![]() kJ/mol;答案:
kJ/mol;答案:![]() kJ/mol;
kJ/mol;
(2)由①2CO(g)+O2(g) ![]() 2CO2(g) ΔH= -akJ/mol;②N2(g)+O2(g)
2CO2(g) ΔH= -akJ/mol;②N2(g)+O2(g) ![]() 2NO(g) ΔH= +bkJ/mol; ③2NO(g)+O2(g)2NO2(g) ΔH= -ckJ/mol ,将①
2NO(g) ΔH= +bkJ/mol; ③2NO(g)+O2(g)2NO2(g) ΔH= -ckJ/mol ,将①![]() 2-(②+③)得CO将NO2还原为单质的热化学方程式为4CO(g)+ 2NO2(g)
2-(②+③)得CO将NO2还原为单质的热化学方程式为4CO(g)+ 2NO2(g) ![]() 4CO2(g) + N2(g) ΔH=-2 akJ/mol-(bkJ/mol -ckJ/mol)=-(2a+b-c)kJ/mol;答案:2NO2(g)+4CO(g)
4CO2(g) + N2(g) ΔH=-2 akJ/mol-(bkJ/mol -ckJ/mol)=-(2a+b-c)kJ/mol;答案:2NO2(g)+4CO(g) ![]() N2(g)+4CO2(g) ΔH=-(2a+b-c)kJ/mol;
N2(g)+4CO2(g) ΔH=-(2a+b-c)kJ/mol;
(3)①在2s内,△c(N2)=![]() △c(NO)=
△c(NO)=![]() (10-2.5)
(10-2.5)![]() 10-4 mol·L-1=3.75
10-4 mol·L-1=3.75![]() 10-4 mol .L-1 ,故v(N2)=
10-4 mol .L-1 ,故v(N2)=![]() =img src="http://thumb.zyjl.cn/questionBank/Upload/2020/11/11/06/eb9fda86/SYS202011110602134907994150_DA/SYS202011110602134907994150_DA.008.png" width="45" height="41" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />10-4mol·L-1= 1.875
=img src="http://thumb.zyjl.cn/questionBank/Upload/2020/11/11/06/eb9fda86/SYS202011110602134907994150_DA/SYS202011110602134907994150_DA.008.png" width="45" height="41" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />10-4mol·L-1= 1.875![]() 10-4 mol·L-1·s-1;答案:1.875
10-4 mol·L-1·s-1;答案:1.875![]() 10-4 mol·L-1·s-1;
10-4 mol·L-1·s-1;
②A.反应物只有NO和CO,根据2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)中,化学计量数之比等于物质的变化量之比,所以在整个反应过程中,一定存在n(CO2) = 2n(N2) ,不能说明化学反应达到平衡状态了, 故A错误;
N2(g)+2CO2(g)中,化学计量数之比等于物质的变化量之比,所以在整个反应过程中,一定存在n(CO2) = 2n(N2) ,不能说明化学反应达到平衡状态了, 故A错误;
B. 由2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)可知,当混合气体的平均相对分子质量不变时,气体物质的量不变,说明混合气体各组分的物质的量不再改变,可以说明反应达到平衡,故B正确;
N2(g)+2CO2(g)可知,当混合气体的平均相对分子质量不变时,气体物质的量不变,说明混合气体各组分的物质的量不再改变,可以说明反应达到平衡,故B正确;
C.气体的密度![]() =
=![]() ,根据质量守恒定律,气体质量不变,容器的体积不变,则气体密度在整个反应过程中始终不变,所以气体密度不变不能作为化学反应达到平衡状态的依据,故C错误;;
,根据质量守恒定律,气体质量不变,容器的体积不变,则气体密度在整个反应过程中始终不变,所以气体密度不变不能作为化学反应达到平衡状态的依据,故C错误;;
D. 由2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)可知,该反应为气体体积减小的反应,故随着反应进行,容器内气体体积减少,压强减小,当压强不变时,说明气体各组分保持平衡不再改变,可以说明反应达到平衡,故D正确;;
N2(g)+2CO2(g)可知,该反应为气体体积减小的反应,故随着反应进行,容器内气体体积减少,压强减小,当压强不变时,说明气体各组分保持平衡不再改变,可以说明反应达到平衡,故D正确;;
综上所述,本题正确答案为BD。
③该反应的正反应放热,升高温度,平衡逆向移动, NO的平衡转化率减小;由方程式2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)可知,正反应为气体体积减小的反应, 相同温度下,增大压强,平衡正向移动,NO的平衡转化率增大,故P1> P2 > P3;
N2(g)+2CO2(g)可知,正反应为气体体积减小的反应, 相同温度下,增大压强,平衡正向移动,NO的平衡转化率增大,故P1> P2 > P3;
答案:该反应正反应放热,升高温度,平衡逆向移动,NO的平衡转化率减小 ; P1>P2>P3。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________;
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%。回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是_____________(写化学式)。
(2)CO可以用于生产甲醇,甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H=-90.8kJ/mol
己知:2H2(g)+O2(g)═2H2O(l) △H=-571.6kJ·mol-1
2H2(g)+O2(g)═2H2O(g) △H=-483.6kJ`mol-1
①H2的燃烧热为___________________ kJ/mol。
②CH3OH(g)+O2(g)![]() CO(g) +2H2O(g)的反应热△H=___________________。
CO(g) +2H2O(g)的反应热△H=___________________。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g)![]() CH3OH(g),则可用来判断该反应达到平衡状态的标志有______________________。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有______________________。(填字母)
A.CO百分含量保持不变 B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变 D.CO的生成速率与CH3OH的生成速率相等
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离。工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式为 CH3COOCu(NH3)2(aq)+CO(g)![]() CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 代表阿伏加德罗常数的值,下列有关说法正确的是
代表阿伏加德罗常数的值,下列有关说法正确的是![]()
![]()
A.![]() 冰醋酸晶体中,含阴离子数目为
冰醋酸晶体中,含阴离子数目为![]()
B.标准状况下,![]() 中含有分子的数目为
中含有分子的数目为![]()
C.常温下,![]() 与
与![]() 混合气体中含分子数为
混合气体中含分子数为![]()
D.![]() 投入
投入![]() 的浓硝酸中,充分反应后转移电子数为
的浓硝酸中,充分反应后转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2![]() Si3N4+6CO。下列叙述正确的是
Si3N4+6CO。下列叙述正确的是
A.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂
B.上述反应中每生成1molSi3N4,N2得到12mol电子
C.若已知上述反应为放热反应,升高温度,上述平衡向正反应方向移动
D.若使压强增大,上述平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.常温下,10 mL pH=1的醋酸溶液中含有的氢离子数为0.001NA
B.合成氨反应中,1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L(不考虑氯气的溶解;电池工作时MnO2转化为MnOOH)
D.常温常压下,18.4 g NO2和N2O4的混合气体中含有的氮原子总数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H__________0。(填“>、<或=”下同)
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H__________0。(填“>、<或=”下同)

(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的__________倍。
(3)利用甲醇燃料电池设计如图所示的装置:

①则该装置中b为____________极,写出装置中电解池内发生反应的离子方程式_______________________。
②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为___________L。
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)= C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)= C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物碱性X>Y
A.③B.①②③④C.①②③D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com